Introduktion #
Under de senaste åren har den traditionella synen på fettvävnad som enbart ett passivt lager för fria fettsyror (FFA) förändrats avsevärt. Det är nu välkänt att fettvävnad spelar en central roll i regleringen av lipid- och glukosmetabolism.
Fettvävnad fungerar dessutom som ett aktivt endokrint organ som producerar ett brett spektrum av bioaktiva molekyler, inklusive hormoner och cytokiner som angiotensinogen, tumörnekrosfaktor-alfa (TNF-α), interleukin-6 (IL-6), adiponektin, leptin och plasminogenaktivatorhämmare-1 (PAI-1).
Fettvävnadens primära och klassiska roller är att isolera och skydda kroppen, lagra FFA efter födointag och frisätta FFA under fasta för att säkerställa tillräcklig energiförsörjning. Under den postprandiella fasen tas FFA upp från blodet av fettvävnaden efter hydrolys av triglycerider (TG) från triglyceridrika lipoproteiner såsom mycket lågdensitetslipoproteinkolesterol (VLDL-C), kylomikroner och deras restprodukter, via lipoproteinlipas (LPL).
Mobilisering av denna reserv sker genom hydrolys av adipocyters TG med hjälp av hormonkänsligt lipas (HSL). Insulin är den huvudsakliga regulatorn av fettinnehållet i adipocyterna, eftersom det både är en kraftfull hämmare av HSL och en viktig aktivator av LPL, vilket därmed ökar upptaget av FFA och triglyceridsyntesen i adipocyter.
Faktorer som frisätts från vit fettvävnad
| Adipokiner och hormoner | Leptin Adiponektin Resistin Hepcidin RPB4 Östrogen |
| Cytokiner | TNF-alfa MCP-1 CCL2, CXCL8 Interleukin-1, interleukin-6 |
| Enzymer och inhibitorer | LPL DPP-4 PAI-1 |
| Lipidtransport | ApoE CETP Kolesterol Gallsyror |
| Övriga faktorer | HIF-alfa Anandamide Lipidderivater |
Organsystem som påverkas av adipokiner från vit fettvävnad
- Hjärna: aptit, mättnadskänsla, temperatur, aktivitetsnivå och glukosmetabolism
- Immunsystem: rekrytering av immunceller, differentiering av immunceller, systemisk inflammation och sårläkning
- Hjärta-kärl: blodtryck, kontraktionsförmåga hos hjärtmuskeln, tonus hos glattmuskulatur
- Lever: insulinkänslighet, ackumulering av lipider, frisättning av hepatokiner, lipidmetabolism, frisättning av tillväxtfaktorer
- Pankreas: insulinkänslighet, insulinsekretion och glukagonsekretion
- Mag-tarmkanal: absorption av näringsämnen och frisättning av inkretiner
- Skelettmuskler: insulinkänslighet, frisättning av myokiner och lagring av lipider
Adipocytokiner #
Begreppen adipokiner och adipocytokiner används ofta synonymt i vetenskapliga sammanhang, men det finns subtila skillnader i deras betydelse och användning
Adipocytokiner är molekyler som påverkar metabolismen och funktionen hos många organ och vävnader, inklusive muskler, lever, kärl och hjärna. Nivåerna av adipocytokiner i plasma ökar i takt med att fettvävnad och adipocytvolym ökar, med undantag för adiponektin som är lägre vid fetma.
Adipocytokiner som frisätts från adipocyter
| Adipocytokin | Effekt |
| Leptin | Matintag, fettmassa |
| Adiponektin Resistin | Insulinresistens, inflammation |
| Visfatin Omentin Vaspin | Insulinresistens |
| Apelin | Vasodilatation |
| CETP (Kolesterylestreröverföringsprotein) LPL (lipoprotein lipas) HSL (hormonkänsligt lipas) A-FABP 4 (Adipocytärt fettsyrabindande protein 4) Perilipin RBP4 (Retinolbindande protein 4) ASP (Acylerande stimulerande protein) | Lipidmetabolism |
| AT II (Angiotensin II) ACE (Angiotensinomvandlande enzym) AGT (Angiotensinogen) | Blodtryck |
| TNF-α (Tumörnekrosfaktor-α) IL-6 (Interleukin-6) CRP (C-reaktivt protein) Adipsin (Adipocyttrypsin) | Inflammation |
| MCP-1 (Makrofagattraherande protein-1) ICAM-1 (Intercellulär adhesionsmolekyl-1) | Makrofagattraktion |
| PAI-1 (Plasminogenaktivatorhämmare-1) | Fibrinolys |
Fettvävnadsdysfunktion vid kardiometabol sjukdom #
Den ökade förekomsten av visceralt fett och fetmarelaterade kardiovaskulära riskfaktorer är nära förknippad med den ökande incidensen av hjärt-kärlsjukdomar och typ 2 diabetes (T2DM). Denna kombination av vaskulära riskfaktorer i visceralt fett kallas ofta för metabolt syndrom.
Sambandet mellan visceralt fett, metabola störningar såsom låggradig inflammation och kardiovaskulära sjukdomar, samt den unika kopplingen till portalcirkulationen, har lett till en ökad förståelse av fettvävnadens endokrina funktioner. I detta sammanhang är fettvävnadens “kvalitet” viktigare än dess “kvantitet”. Ändå är mängden visceralt fett en avgörande faktor för fettvävnadens funktion.
Fysiologisk roll för adipocyter och fettvävnad
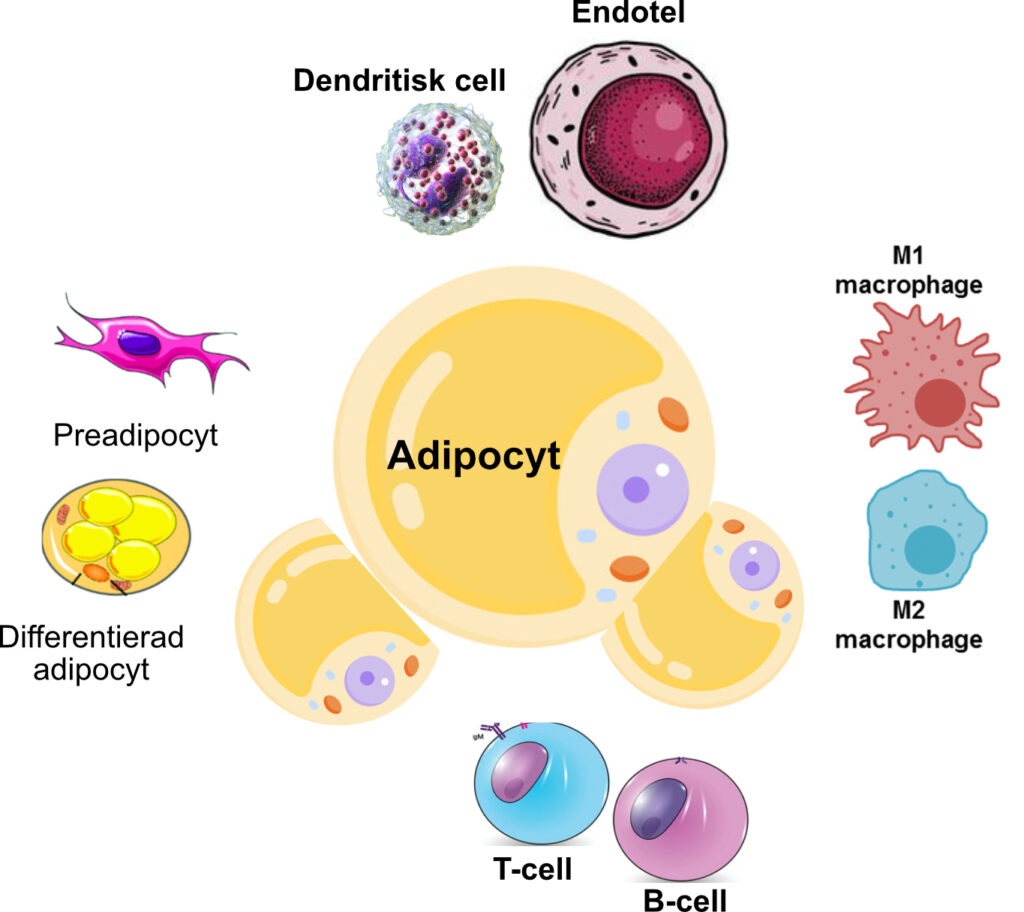
Fettvävnad består av adipocyter samt en vaskulär-stromal fraktion som inkluderar makrofager, fibroblaster, endotelceller, pre-adipocyter, differentierade adipocyter och lymfocyter. Pre-adipocyter härstammar från mesodermala stamceller och förmågan att bilda nya fettceller kvarstår under hela livet.
Visceralt och subkutant fett har distinkta funktioner. Visceralt fett uttrycker högre nivåer av gener relaterade till blodtrycksreglering och inflammation. Det är även mer kopplat till portalcirkulationen, vilket innebär att visceralt fett har en direkt effekt på leverns funktion. Visceralt fett är också en större källa till inflammatoriska cytokiner som IL-6 och TNF-α, som bidrar till insulinresistens och dyslipidemi.
Adiponektin, som huvudsakligen produceras av subkutant fett, minskar med ökad visceralt fett och insulinresistens. Detta antyder att visceralt fett spelar en central roll i den metabola dysfunktionen vid fetma och T2DM.
Fetma leder till fettvävnadsdysfunktion
Makrofager är mer förekommande i fettvävnaden hos individer med fetma än hos normalviktiga. Dessa makrofager delas in i två typer: M1-makrofager, som dominerar vid fetma och frisätter proinflammatoriska cytokiner som TNF-α och IL-6, samt M2-makrofager, som producerar antiinflammatoriska cytokiner som IL-10 och bidrar till vävnadsreparation. Intressant nog minskar antalet makrofager i fettvävnaden efter viktminskning.
Adipocyter förstoras vid överätande och frisätter mer mättade fettsyror, vilka kan binda till TLR-4-receptorer på makrofager. Detta aktiverar NF-κB och ökar produktionen av TNF-α, som i sin tur stimulerar adipocyterna att frisätta cytokiner som IL-6 och MCP-1.
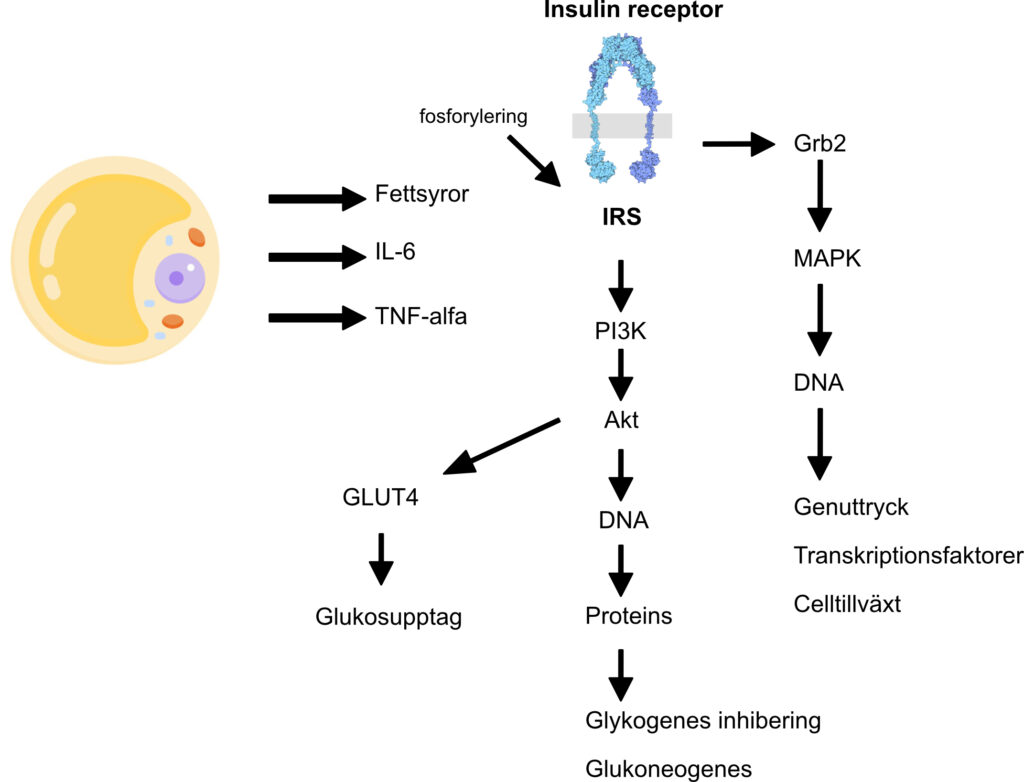
MCP-1 och ICAM-1 främjar dessutom infiltration av monocyter från blodet till fettvävnaden, där de differentierar till makrofager. Denna parakrina interaktion mellan adipocyter och makrofager förstärker en ond cirkel av inflammation.
Stora adipocyter producerar mindre adiponektin, ett hormon som normalt hämmar inflammation genom att blockera TLR-4-aktiverad NF-κB. Låga adiponektinnivåer förstärker därför den inflammatoriska processen. Mättade fettsyror från kosten kan direkt aktivera TLR-4, medan fleromättade fettsyror hämmar dess aktivering.
För att säkerställa tillräcklig närings- och syretillförsel samt transport av fettsyror och adipocytokiner krävs en utökad mikrovaskulatur i fettvävnaden. Vid hypertrofi av adipocyter kan hypoxi uppstå på grund av otillräcklig perfusion. Detta leder till uttryck av hypoxirelaterade faktorer som VEGF och PAI-1, vilka hämmar adiponektinproduktionen och ökar leptin- och PAI-1-transkriptionen. Sådana förändringar är en del av cellens svar på hypoxi och stress.
Adipocytstorlek vs funktion
Kvaliteten på fettsyrorna, inte bara mängden, påverkar också adipocyternas funktion. Fleromättade fettsyror, som de som finns i fiskolja, ökar aktiviteten av fettsyreoxiderande enzymer och höjer adiponektinnivåerna genom aktivering av PPAR-γ. Detta har kopplats till minskad dödlighet och sjuklighet hos patienter som genomgått hjärtinfarkt.
En förstoring av adipocyter leder till ökad sekretion av både fria fettsyror (FFA) och TNF-α, vilka spelar en central roll i utvecklingen av insulinresistens. FFA:s negativa effekt på insulinkänsligheten förstärker lipolysen i adipocyter genom att minska insulins hämmande effekt på hormonkänsligt lipas (HSL), vilket är ett nyckelenzym i triglyceridnedbrytningen. TNF-α bidrar ytterligare till insulinresistens genom att uppreglera triglyceridhydrolys och hämma uttrycket av gener som är viktiga för insulinsignalering och adipocytdifferentiering, inklusive CCAAT-enhancer-binding protein-α, PPAR-γ och adiponektin.
Adiponektin förbättrar insulinkänsligheten genom att hämma leverns glukosproduktion och öka fettsyreoxidationen i lever och muskulatur via aktivering av 5’AMP-aktiverat proteinkinas. Genetiska variationer, såsom SNPs (single-nucleotide polymorphisms) i adiponektin-genens promotorregion, har kopplats till utvecklingen av insulinresistens, fetma och typ 2-diabetes. Hos svårt överviktiga individer har SNPs i adiponektin-genen förknippats med en fördubblad risk för typ 2-diabetes.
Den höga förekomsten av icke-alkoholisk fettlever (NAFLD) hos överviktiga, insulinresistenta och diabetiska patienter kan delvis förklaras av fettvävnadsdysfunktion. Ökat flöde av fettsyror och IL-6 genom portacirkulationen bidrar till lipidinlagring i levern. Leptin har också föreslagits vara en mediator av leverfibros vid kronisk leverskada, även om dess effekt kan minska vid leptinresistens. Substitution av adiponektin i djurmodeller har visat sig förbättra hepatomegali och steatos genom att motverka effekterna av TNF-α.
Adipocyt-hypertrofi
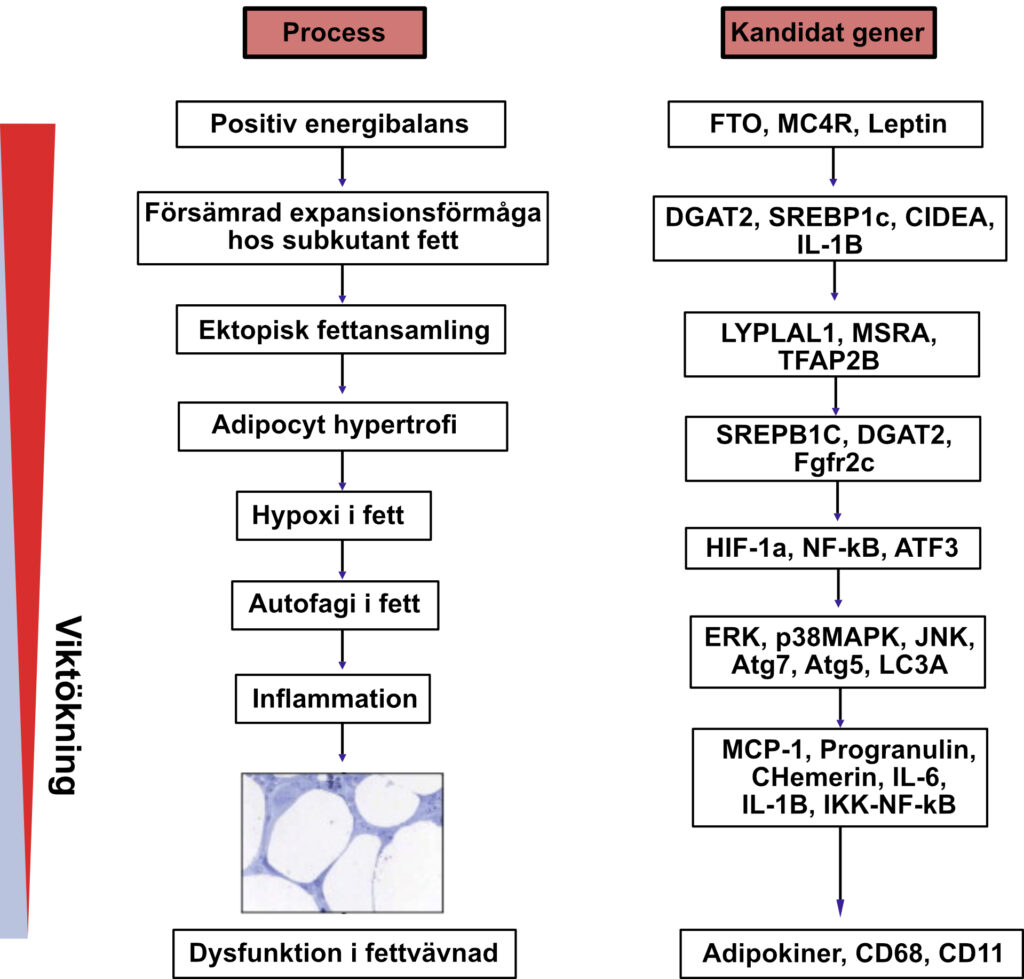
Adipocyt-hypertrofi, som innebär förstoring av adipocyter med ökad triglyceridlagring, är en nyckelfaktor i utvecklingen av fetmarelaterade kardiovaskulära och metabola sjukdomar. Hypertrofi är starkt kopplad till nedsatt insulinkänslighet, glukos- och lipidmetabolism och förekommer ofta vid låga nivåer av ny adipocytbildning (adipogenes). Däremot är hög adipogenes kopplad till adipocyt-hyperplasi, vilket kan vara skyddande mot metabola störningar.
- Adipocytantal och barndom: Antalet adipocyter etableras huvudsakligen under barndomen och tonåren. Hos vuxna är hypertrofi av adipocyter den främsta mekanismen för fettvävnadsexpansion vid fetma.
- Hälsokonsekvenser av hypertrofi: Hypertrofisk fettvävnad är associerad med låggradig inflammation, dyslipidemi och försämrad insulinkänslighet. Stora subkutana adipocyter är särskilt kopplade till glukos- och insulinrubbningar, medan hyperplasi kan skydda mot dessa tillstånd.
- Inflammatoriska markörer: Hypertrofisk fettvävnad uppvisar förhöjda nivåer av inflammatoriska markörer som CRP, IL-6, MCP-1 och chemerin, medan mindre fettceller visar färre inflammatoriska förändringar.
Adipocytens storlek påverkar också sekretionsmönstret och driver en ökad frisättning av proinflammatoriska adipokiner, vilket bidrar till systemisk inflammation och oxidativ stress.
Hypoxi i fettvävnad
När fettvävnaden expanderar i volym kan vissa adipocyter hamna längre från blodkärlen, vilket leder till lokal hypoxi. Denna syrebrist är föreslagen som en tidig mekanism för att initiera och driva inflammatoriska svar i fettvävnaden vid fetma.
- Effekter av hypoxi: Hypoxi kan inducera oxidativ stress och endoplasmatiskt retikulumstress, vilket bidrar till dysfunktion i fettvävnaden. Experimentella studier har visat att hypoxi stimulerar sekretion av inflammationsrelaterade adipokiner, inklusive VEGF, IL-6, leptin och MIF-1.
- VEGF och glukosmetabolism: Även om VEGF-A uttrycks under hypoxi och har proangiogena egenskaper, har det också visats förbättra glukosmetabolism och insulinkänslighet. Detta antyder att VEGF inte är den primära länken mellan hypoxi och fettvävnadsdysfunktion.
- Begränsningar i hypoxihypotesen: Forskning har ifrågasatt hypoxins roll i fettvävnadens dysfunktion, eftersom studier på mänsklig fettvävnad visar minskad O₂-leverans men också låg O₂-konsumtion, vilket inte nödvändigtvis stöder ett hypoxiskt tillstånd.
Autofagi och fettvävnadens biologi #
Studier har visat att autofagi spelar en viktig roll i lipidmetabolism och fettvävnadens biologi, särskilt genom att reglera balansen mellan vita och bruna adipocyter.
- Musstudier: Möss med en adipos-specifik deletion av autofagiggenen Atg7 har visat sig vara magra, insulinkänsliga, ha högre metabolisk aktivitet och vara resistenta mot fetma. Detta tyder på att autofagi påverkar fettmassan och metabolismen.
- Humanstudier: Autofagi är uppreglerad i fettvävnaden hos individer med fetma och/eller typ 2-diabetes, särskilt i omentalt fett. Markörer för autofagi korrelerar med graden av fetma, visceralt fett och adipocyt-hypertrofi.
Autofagins koppling till metabola sjukdomar
- Insulinresistens och fettvävnadsdysfunktion: Autofagiens ökade aktivitet i fettvävnad hos individer med fetma kan både vara ett tecken på försämrad funktion och en mekanism för att motverka skador.
- Skyddande eller patogen mekanism?: Autofagi kan representera en tidigare okänd mekanism som antingen skyddar mot fetmarelaterad dysfunktion i fettvävnaden eller är ett symptom på redan pågående skador.
Fettvävnadens distribution och funktioner #
Subkutant fett
Subkutant fett är huvudsakligen lokaliserat till övre och nedre kroppens fettdepåer och utgör cirka 80 % av all fettvävnad hos friska, smala individer. Det fungerar som en “metabolisk buffert” för överflödigt energiintag och lagrar fett när energiförbrukningen är låg. När lagringskapaciteten överskrids, exempelvis på grund av begränsad förmåga att bilda nya adipocyter (hyperplasi) eller expandera befintliga adipocyter (hypertrofi), lagras fett ektopiskt, exempelvis i viscerala depåer.
Subkutant fett fungerar också som en isolator, skyddar mot värmeförlust och fungerar som en fysisk barriär mot infektion och mekanisk stress. Det har visats att subkutant fett, särskilt i de nedre regionerna (gluteo-femoralt), har gynnsamma effekter på glukosmetabolismen.
Epikardiellt fett
Epikardiellt fett (epiWAT) är lokaliserat nära hjärtat och delar mikrocirkulation med myokardiet. EpiWAT är dubbelt så metabolt aktivt som andra fettdepåer och frisätter fettsyror och adipokiner som adiponektin och inflammatoriska cytokiner. Fettdepån bidrar till hjärtats energibehov genom lipolys, men vid fetma kan förstorad epiWAT bidra till metabola syndromets egenskaper och hjärtrelaterade komplikationer.
Perivaskulärt fett
Perivaskulärt fett (PVAT) omger blodkärl och har egenskaper som liknar både brunt fett (BAT) och vitt fett (WAT). PVAT spelar en aktiv roll i vaskulär homeostas genom att producera bioaktiva molekyler som adipokiner (t.ex. leptin, adiponektin), cytokiner (t.ex. IL-6, TNF-α) och vasoaktiva ämnen (t.ex. kväveoxid). Vid dysfunktion, exempelvis vid fetma, kan PVAT bidra till ateroskleros snarare än att skydda kärlen.
Visceralt fett
Visceralt fett, lokaliserat i buken, är en typ av ektopiskt fett som är metabolt aktivt och konstant frisätter fria fettsyror (FFA) till portacirkulationen. Detta bidrar till metabola störningar som hyperinsulinemi, inflammation, dyslipidemi och ateroskleros. Visceralt fett är nära kopplat till negativa metabola konsekvenser.
Beige fett
Beige fett, även kallat “brite” (brown-in-white), är bruna adipocyter som bildas inom vita fettdepåer under vissa förhållanden, exempelvis kyla eller fysisk aktivitet. Beige fett delar funktioner med BAT, som fettförbränning och värmeproduktion, men har unika genuttryck. Beige adipocyter kan aktiveras snabbt från ett vilande tillstånd och kan vara viktiga för att motverka fetmainducerade metabola störningar.
Brunt fett #
Brunt fett (BAT) är specialiserat på att generera värme genom icke-skakande termogenes och bidrar till att minska plasmatriglycerider och förhindra ektopisk fettlagring. Hos vuxna människor finns BAT i mindre mängder (1–2 % av total fettmassa), lokaliserat till områden som nacke och paraspinalregioner. BAT utsöndrar bioaktiva molekyler, kallade “batokiner”, som potentiellt har endokrina funktioner.
Forskningen om fettvävnadens funktion som ett endokrint organ har gjort stora framsteg, särskilt genom identifieringen av bioaktiva lipider och andra signalmolekyler med lokala och systemiska effekter. Brun fettvävnad (BAT) frisätter bioaktiva lipider som 12,13-dihydroxy-9Z-octadecensyra (12,13-diHOME) och 12-hydroxyeikosapentaensyra (12-HEPE), vilka stimulerar glukos- och fettsyreupptag i både BAT och muskler för att stödja termogenesen. Dessutom frisätter BAT exosomala mikroRNA som reglerar genuttryck i andra vävnader, såsom levern.
Vit och brun fettvävnad i metabolism
Både vit fettvävnad (WAT) och BAT är centrala för reglering av lipoprotein- och gallsyrametabolism. Triglyceridrika lipoproteiner, som kylomikroner från födan och leverhärledda mycket lågdensitetslipoproteiner (VLDL), levererar lipider till WAT och BAT. Långvarig BAT-aktivering hos gnagare har visat sig påverka leverns kolesterolhomeostas, gallsyrametabolism och tarmmikrobiomens sammansättning. Ny forskning tyder på att aktivering av BAT hos vuxna människor kan minska risken för ateroskleros och öka glukos- och lipidförbrukningen i skelettmuskulaturen.
Immunologiska funktioner hos brun fettvävnad
WAT och BAT spelar båda roller i immunmodulering, men deras effekter skiljer sig.
- Vit fettvävnad (WAT): Vid fetma utsöndrar WAT proinflammatoriska cytokiner, såsom TNF-α, interleukin-1β och interleukin-6, som rekryterar makrofager. Andelen makrofager i fettvävnaden kan öka från under 10 % till nästan 40 %. Dendritiska celler och B-celler bidrar också till att expandera CD4- och CD8-T-celler, vilket förvärrar insulinresistens och ökar frisättningen av fettsyror. Detta driver i sin tur på glukoneogenesen i levern och leder till hyperglykemi.
- Brun fettvävnad (BAT): BAT är mer motståndskraftig mot inflammation orsakad av fetma. I gnagarmodeller uttrycker BAT höga nivåer av programmerad dödsligand-1 (PD-L1), vilket minskar T-cellaktivering och kan förbättra insulinkänsligheten.
Definition av fetma och fettfördelningsmönster
Diagnos och klassificering av fetma
Fetma diagnostiseras och klassificeras oftast med hjälp av Body Mass Index (BMI), ett enkelt mått som beräknas utifrån kroppsvikt och längd. BMI är oberoende av kroppslängd och korrelerar rimligt väl med kroppsfettmassan (korrelationskoefficient 0,4–0,7).
- Kategorier enligt WHO:
- BMI >30 kg/m²: Definieras som fetma och delas in i tre klasser baserat på svårighetsgrad.
- BMI 25–29,9 kg/m²: Kategoriseras som övervikt eller pre-fetma och kräver ytterligare bedömning av hälsorisker.
- I västerländska länder faller 30–50% av befolkningen i kategorin övervikt.
Fettfördelningens betydelse
Förutom mängden kroppsfett är den anatomiska placeringen av kroppsfett avgörande för risken för metabola och hjärt-kärlkomplikationer. Detta är särskilt relevant för individer med måttlig övervikt och BMI i den övre normalintervallet.
- Variationer i fettfördelning:
- Vid samma BMI kan fettfördelningsmönstret variera avsevärt.
- CT- och MRI-skanningar visar på stor skillnad i storleken på intra-abdominell visceralt fett.
- Midjemått som praktiskt verktyg:
- Midjemått, mätt mellan nedre revbenskanten och övre höftkammen, används för att bedöma fettfördelningen.
- Midjemått är starkt korrelerat med BMI men kan inte skilja mellan subkutana och intra-abdominella fettdepåer.
Riskbedömning baserat på midjemått
Midjemått används som en enkel indikator för att bedöma risken för metabola och kardiovaskulära komplikationer.
- Tröskelvärden för midjemått:
- Dessa har fastställts genom många studier och baseras på omfattande human data.
- Ett högt midjemått indikerar en ökad risk även vid ett BMI inom det övre normalintervallet.
Riskökning för T2DM #
Sambandet mellan fetma och T2DM
Ett omfattande antal kliniska data visar på ett nära samband mellan kroppsfettmassa och risken för att utveckla diabetes. Till skillnad från andra metabola störningar kopplade till fetma ökar diabetesrisken redan i den övre normalintervallet för BMI.
- Resultat från studier:
- Kvinnor med ett BMI mellan 23,0–24,9 kg/m² hade en fyra- till femfaldig ökad risk för diabetes jämfört med kvinnor med ett BMI under 22 kg/m².
- Kvinnor med ett BMI på 29,0–30,9 kg/m² hade en 27,6 gånger högre risk.
- Två tredjedelar av kvinnor med nydebuterad typ 2-diabetes (T2DM) var feta vid diagnos.
Viktförändringar och diabetesrisk
- Viktökning:
- Kvinnor som ökade sin vikt med 11–19,9 kg efter 18 års ålder hade en 5,5 gånger högre risk för diabetes.
- Viktnedgång:
- Viktminskning av samma omfattning minskade risken med cirka 80%.
- Viktens påverkan över tid:
- Viktökning med en BMI-enhet mellan 25 och 40 års ålder ökade risken för T2DM med 25%.
Betydelsen av fetmans varaktighet
Längre tid med fetma har en stark koppling till en högre risk för att utveckla diabetes. I USA mellan 1976 och 2004 bidrog ökningen i fetma till majoriteten av ökningen i diabetesprevalens, där 81% av den ökade prevalensen kunde tillskrivas olika grader av fetma.
Fettfördelningens betydelse
Förutom nivån och varaktigheten av fetma är fettfördelningen en avgörande faktor för diabetesrisken.
- Abdominellt fett:
- Tidiga studier visade att bukfett är en oberoende riskfaktor för T2DM.
- Speciellt vid måttlig övervikt och till och med i den övre normalintervallet för BMI predicerar fettfördelningen starkt risken för diabetes.
- Midjemått:
- Bör mätas regelbundet vid diabetesriskbedömning, även hos normalviktiga individer.
- Kardiovaskulär risk:
- Endast individer med abdominal fettfördelning har en ökad risk för hjärtsjukdomar bland överviktiga och feta.
Genetisk predisposition för fetma och T2DM #
Familj- och tvillingstudier
Studier visar att fetma, liksom T2DM, har en stark genetisk grund.
- Adoptionsstudier:
- Inget samband mellan adopterade barns BMI och deras adoptivföräldrar, men en stark korrelation med biologiska föräldrar, särskilt moderns BMI.
- Tvillingstudier:
- Högre samstämmighet för BMI hos enäggstvillingar jämfört med tvåäggstvillingar.
- Visar på betydande genetisk kontroll av kroppsfettnivåer.
Monogena fetmasjukdomar
Under det senaste decenniet har flera monogena fetmasjukdomar identifierats, särskilt hos barn med tidig fetmadebut.
- Exempel på genetiska mutationer:
- Mutationer i leptin–melanocortin-signalvägen.
- Mutationer i melanocortin-4-receptor-genen (MC4R) är den vanligaste orsaken till monogen fetma hos barn.
GWA-studier och genetik på populationsnivå
Storskaliga genomkopplingsstudier har identifierat vanliga genetiska varianter som predisponerar för fetma, ofta kopplade till centrala mekanismer för aptitreglering.
- FTO-genen:
- Påverkar kroppsvikt med upp till 3 kg mellan individer med hög- respektive låg-riskallel.
- Andra genvarianter:
- Mindre effekt, ofta mindre än 1 kg i påverkan på kroppsvikten.
Fetma som en heterogen sjukdom
Fetma representerar en blandad grupp av genetiska och miljömässiga faktorer.
- Samband med T2DM:
- Endast individer med genetisk predisposition för nedsatt β-cellfunktion utvecklar diabetes, även vid svår fetma (BMI ≥40 kg/m²).
- Bland svårt feta utvecklar endast 30–40% diabetes under sin livstid.
Epigenetik och utveckling av fetma/diabetes #
Epigenetiska mekanismer och utveckling av fetma och T2DM
En viktig faktor i utvecklingen av fetma och typ 2-diabetes mellitus (T2DM) är epigenetiska mekanismer som påverkar genuttryck under fosterlivet. Även om detta fortfarande är ett relativt outforskat område, tyder observationer på att epigenetik kan spela en avgörande roll.
- Fosterpåverkan och diabetesrisk:
- Barn till mödrar med graviditetsdiabetes har en ökad risk att utveckla fetma i barndomen.
- Syskon födda efter att modern utvecklat graviditetsdiabetes löper större risk för T2DM i ung vuxen ålder.
- Hormonella förändringar under graviditeten:
- Hyperglykemi och kronisk övernutrition under graviditet kan leda till fostrets hyperinsulinemi, hyperkortisolemi och hyperleptinemi.
- Dessa hormonella förändringar kan orsaka en långvarig störning av hypothalamusfunktioner som reglerar energibalans och metabolism.
Epigenetiska processer
Det spekuleras att epigenetiska mekanismer såsom DNA-metylering, histonmodifieringar och förändringar i mikroRNA-mönster påverkar dessa utvecklingsprocesser. Djurexperiment tyder på att dessa processer främst påverkar centrala neuroendokrina vägar som reglerar aptit och energiomsättning.
Patofysiologiska länk mellan fetma och T2DM #
T2DM kännetecknas av nedsatt insulinverkan, defekt insulinsekretion eller båda. Dessa defekter är närvarande långt innan sjukdomen diagnostiseras kliniskt. Fetma har visats vara en viktig faktor som påverkar båda dessa mekanismer. Trots betydande framsteg är de exakta mekanismerna genom vilka fetma ökar risken för T2DM fortfarande ofullständigt förstådda. Här följer en genomgång av de huvudsakliga faktorerna.
Lipider och insulinresistens
Glukos–fettsyra-cykeln
Den tidigaste hypotesen om kopplingen mellan fetma och T2DM var den så kallade glukos–fettsyra-cykeln. Den bygger på en konkurrens mellan glukos och fettsyror vid oxidation i muskler, särskilt hjärtmuskeln. När tillgången på fria fettsyror ökar:
- Effekter på glukosmetabolism:
- Fettsyror konkurrerar med glukos som energikälla, vilket hämmar glykolytiska enzymer som pyruvatdehydrogenas och hexokinas.
- Glukosoxidationen minskar, vilket höjer glukoskoncentrationerna i blodet.
- Glycerol frisätts från fettvävnad och återanvänds i levern för att producera glukos, vilket ytterligare förvärrar obalansen.
Intramyocellulär lipidackumulering
Hos individer med fetma och T2DM har studier visat en hög ansamling av lipider i muskler. Denna ansamling inkluderar:
- Lipidderiverade metaboliter:
- Ceramider, diacylglycerol och fettsyre-CoA.
- Dessa metaboliter stör insulinsignaleringen genom att aktivera serin–treonin-kinas-kaskader, vilket påverkar insulins receptor-substrat (IRS) negativt.
Lipider och β-cellfunktion
Effekter av fettsyror
Fettsyror påverkar både positivt och negativt β-cellernas funktion:
- Stimulerande effekter:
- Långkedjiga fettsyror stimulerar insulinsekretion genom att aktivera protein kinas C.
- G-proteinkopplade receptorer (GPR 40) på β-cellernas membran kan öka intracellulär kalciumkoncentration och insulinfrisättning.
- Negativa effekter vid kronisk exponering:
- Långvarig exponering för höga fettsyrekoncentrationer försämrar β-cellernas glukosstimulerade insulinsekretion.
- Uppreglering av uncoupling protein 2 (UCP-2) kan störa mitokondriell metabolism och därigenom påverka insulinproduktionen.
Mitokondriella dysfunktioner
Mitokondriernas förmåga att metabolisera fettsyror är avgörande för glukosmetabolismen. Defekter i denna process har kopplats till insulinresistens och β-cellssvikt.
Fettvävnad som sekretoriskt organ
Inflammatoriska cytokiner
Fettvävnad producerar och frisätter flera ämnen som kan bidra till insulinresistens:
- Tumor necrosis factor α (TNF-α):
- Första cytokinen som identifierades i fettvävnad.
- Hämmar glukosupptag och ökar lipolys.
- Aktiverar NF-κB-vägen, vilket ökar produktionen av inflammatoriska proteiner som IL-6 och MCP-1.
- Andra proinflammatoriska faktorer:
- Retinolbindande protein 4 (RBP-4) och plasminogenaktivatorhämmare 1 (PAI-1).
- Dessa ämnen påverkar insulinsignalering och glukosmetabolism negativt.
Adiponectin – en skyddande faktor
Adiponectin, en proteinrik produkt från fettceller, har visat sig ha flera antidiabetiska effekter:
- Effekter:
- Stimulerar fettsyraoxidation via AMP-aktiverat proteinkinas.
- Minskar insulinresistens och har antiinflammatoriska egenskaper.
Signalvägar för inflammation i fettvävnad
Modern forskning visar att inflammatoriska reaktioner vid fetma är kopplade till aktivering av signalvägar som c-Jun N-terminal kinas (JNK) och IKKβ–NF-κB. Dessa vägar aktiveras av cytokiner som TNF-α och IL-6, men även av lipider. Experimentella studier har visat att genetisk eller kemisk hämning av dessa signalvägar kan minska inflammation och förbättra insulinresistens.
JNK och IKKβ–NF-κB i fettvävnad
- JNK:
- Aktiviteten är förhöjd i fettvävnad, lever och muskler vid fetma.
- Förlust av JNK1 hos möss skyddar mot insulinresistens och diabetes vid fetma.
- IKKβ–NF-κB:
- IKKβ kan fosforylera IRS-1 på serinrester och aktivera NF-κB.
- NF-κB stimulerar produktionen av proinflammatoriska mediatorer som TNF-α och IL-6.
- Möss med en partiell förlust av IKKβ är delvis skyddade mot insulinresistens.
Toll-liknande receptorer (TLR) och lipider
- TLR-4:
- Aktiveras av mättade fettsyror i adipocyter.
- Möss utan TLR-4 är skyddade mot fetmainducerad insulinresistens och har lägre NF-κB- och JNK-aktivitet.
Adipocyter och makrofager som inflammationskällor
I fettvävnad är många av de inflammatoriska proteinerna inte direkt producerade av fettceller utan av:
- Pre-adipocyter och makrofager.
- Makrofager frisätter faktorer som förstärker adipocyternas inflammation och insulinresistens.
Fettcellernas storlek och inflammation
- Hypertrofa fettceller (förstorade fettceller) visar ett skifte mot ett proinflammatoriskt tillstånd.
- Kliniska data kopplar fettcellshypertrofi till en ökad risk för T2DM.
Fetma och endoplasmatiskt retikulumstress
ER-stress och signalering
Fetma och kronisk överkonsumtion av näring överbelastar endoplasmatiskt retikulum (ER), vilket bidrar till:
- Aktivering av JNK-signalvägen.
- Systemisk överuttryck av 150-kDa oxygenreglerat protein (ORP150) i en musmodell, vilket förbättrar insulinkänslighet.
Fetma och oxidativ stress
Fetma är kopplad till systemisk oxidativ stress, vilket kan orsaka:
- Dysreglering av adipokiner som adiponectin och IL-6.
- Ökad produktion av reaktiva syreradikaler (ROS) i adipocyter genom NADPH-oxidas.
Effekter av NADPH-oxidas-hämmare
- Minskad ROS-produktion.
- Återställd adipokinbalans.
- Förbättring av diabetes och dyslipidemi.
Hypoxi i fettvävnad
Orsaker och konsekvenser
- Expansion av fettvävnad leder till hypoxi (syrebrist).
- Hypoxi bidrar till:
- Kronisk inflammation.
- Minskad adiponectinproduktion.
- Mitokondriell dysfunktion.
Hypoxi-relaterade genuttryck
- Ökad aktivitet av gener som HIF-1α och VEGF.
- Viktminskning genom kirurgi minskar uttrycket av dessa gener.
Immuncellansamling i fettvävnad
Fettvävnad hos överviktiga visar en hög nivå av infiltrerade immunceller, särskilt:
- Makrofager.
- T-lymfocyter, som rekryteras av kemokiner som SDF-1.
Visceralt fett och komplikationer
- Immuncellsinfiltration är mer uttalad i visceralt fett än i subkutant fett.
- Detta stöder teorin att visceralt fett är en nyckelfaktor bakom de metabola och kardiovaskulära komplikationerna vid fetma.
Betydelsen av kroppsfördelning av fett
Visceralt fett och dess påverkan
Tidiga kliniska studier visade att individer med en abdominal fettfördelning löper högre risk att utveckla typ 2-diabetes (T2DM) och andra metabola och kardiovaskulära komplikationer. Nyligen har det blivit tydligt varför detta sker:
- Viscerala fettceller:
- Har högre lipolytisk aktivitet jämfört med subkutana fettceller.
- Samlar fler lymfocyter och makrofager, vilket bidrar till högre proinflammatorisk aktivitet.
- Dräneras via portavenen, vilket exponerar levern direkt för fettsyror och proteiner som frisätts från fettdepån, vilket kan leda till insulinresistens i levern.
Kronisk inflammation och insulinresistens
- Visceralt fett är ofta kopplat till fettansamling i levern och kan bidra till leverinsulinresistens genom inflammatoriska processer.
- En högfett- och högsockerbaserad kost, kombinerat med andra livsstilsfaktorer som fysisk inaktivitet, kan leda till systemisk insulinresistens och påverka lever, muskler och hjärnan.



