Fettvävnad och det kardiovaskulära systemet #
Expansion och dysfunktion av fettvävnad bidrar till utvecklingen av kardiovaskulär sjukdom (CVD) genom en rad sammanhängande direkta och indirekta mekanismer. Fetma är känt för att inducera hypertoni, sannolikt genom mekanisk kompression av njurarna till följd av expansion av visceralt fett (VAT), aktivering av det sympatiska nervsystemet samt renin-angiotensin-aldosteronsystemet (RAAS), oberoende av aldosteron och en mild brist på natriuretisk peptid.
Fettvävnadsinflammation och dess efterföljande dysfunktion, vilka är förknippade med fetma, utgör också centrala faktorer för insulinresistens. Detta kan i sin tur leda till typ 2-diabetes mellitus och dess välkända negativa effekter på såväl mikro- som makrovaskulär funktion. Dysfunktionell fettvävnad kan även främja trombos genom ökad produktion av isoprostaner och vävnadsfaktorer, samt genom att inducera insulinresistens i trombocyter och aktivera dessa.
Förutom dessa indirekta mekanismer utövar fettvävnaden också direkta effekter på det kardiovaskulära systemet genom att utsöndra ett brett spektrum av bioaktiva adipocytokiner. Dessa inkluderar adipokiner (såsom adiponectin) och pro-inflammatoriska cytokiner, liksom andra produkter såsom mikroRNA, mikroveisklar, oorganiska molekyler som vätesulfid (H₂S) och fettsyremetaboliter.Dessa molekyler kan ha autokrina effekter på fettvävnaden själv men kan även reglera biologiska processer i närliggande eller avlägsna vävnader via endokrina, parakrina och vasokrina mekanismer.
Fettvävnadens direkta effekter på det kardiovaskulära systemet #
Fettvävnad utövar direkta effekter på det kardiovaskulära systemet genom sekretion av ett brett spektrum av bioaktiva produkter, inklusive adipocytokiner, mikroveisklar, oorganiska molekyler och reaktiva syreradikaler.
Bioaktiva produkter från fettvävnad i avlägsna depåer, såsom subkutan fettvävnad, frisätts i blodomloppet via fettvävnadens mikrokärl. Dessa molekyler kan nå avlägsna målorgan, såsom hjärtat och artärerna, där de utövar sina biologiska effekter på ett endokrint sätt.
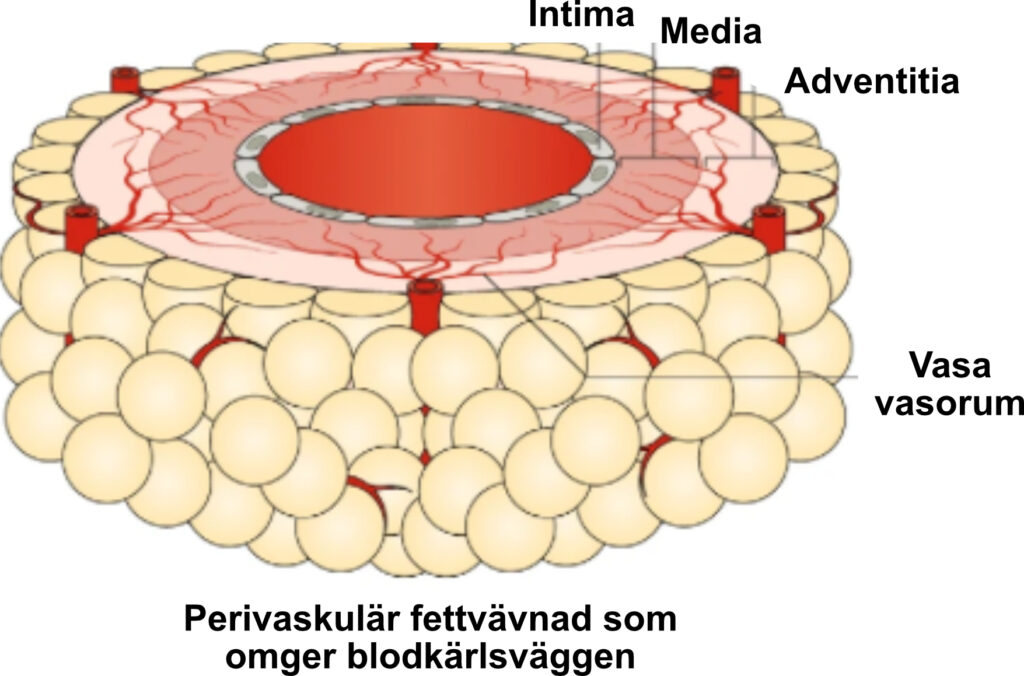
Utöver dessa endokrina effekter kan perivaskulär fettvävnad (PVAT) och epikardiell fettvävnad (EAT) utöva direkta effekter på den närliggande kärlväggen respektive myokardiet genom parakrin frisättning av bioaktiva mediatorer. Eftersom PVAT ofta ligger i nära anslutning till den yttre adventitiala lagret av kärlväggen, kan vasa vasorum underlätta den lokala transporten av dessa molekyler.
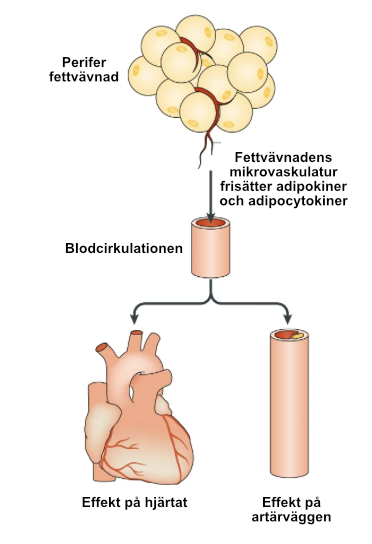
I vissa fall kan produkter från PVAT nå lumen i det angränsande kärlet och transporteras nedströms, vilket gör det möjligt att reglera biologin hos hela kärlbäddar via vasokrina mekanismer.
Fettvävnadens roll i samspel med kärlväggen #
Fettvävnad är involverad i ett bidirektionellt samspel med kärlväggen genom frisättning av flera bioaktiva produkter som verkar antingen endokrint (genom systemiskt blodflöde) eller parakrint (lokalt). Bland fettvävnadens olika depåer har perivaskulär fettvävnad (PVAT) identifierats som en central regulator av kärlbiologi.
Dess anatomiska närhet till kärlen underlättar parakrina interaktioner. Fettvävnaden utsöndrar ett brett spektrum av bioaktiva produkter, inklusive adipokiner (som adiponectin, leptin och resistin), kemokiner, cytokiner, gasformiga signalmolekyler (såsom vätesulfid [H₂S] och kväveoxid [NO]), fettsyror (exempelvis palmitinsyrametylester), reaktiva syreradikaler och mikropartiklar som kan bära mikroRNA och andra molekyler till de närliggande kärlen.
Effekter på kärlväggen
Inne i kärlväggen har dessa molekyler pleiotropa effekter på flera måltavlor och påverkar:
- Redoxstatus: Molekyler från fettvävnad reglerar lokala redoxprocesser genom modulation av NADPH-oxidas (NOX)-aktivitet och koppling av endotelial kväveoxidsyntas (eNOS).
- Endotelial funktion: Reglering av eNOS-aktivitet och NO-tillgänglighet påverkar endotelfunktionen.
- Inflammation: Signalering från fettvävnad bidrar till lokal endotelial aktivering och reglering av makrofagers M1–M2-polarisering.
- Glatta muskelceller: Molekyler från fettvävnad påverkar migration av vaskulära glatta muskelceller, neointimaformation och kärltonus.
Omvänd påverkan: från kärl till fettvävnad
Förutom signalering från fettvävnad till kärlväggen kan inflammation och oxidativ stress i kärlen påverka fettvävnadens biologi, särskilt PVAT. Pro-inflammatoriska signaler och lipidperoxidationsprodukter, såsom 4-hydroxynonenal, kan diffundera till närliggande PVAT och aktivera signalvägar i adipocyterna.
Kärltonus under hälsosamma förhållanden
Under normala förhållanden reglerar fettvävnaden kärltonus genom frisättning av molekyler med vasodilaterande egenskaper:
- Adiponectin: Inducerar eNOS-fosforylering via AMPK- och AKT-signalering.
- Vätesulfid (H₂S): Aktiverar ATP-reglerade kaliumkanaler.
- Palmitinsyrametylester: Aktiverar spänningsberoende kaliumkanaler.
Förändringar vid fetma och insulinresistens #
Vid fetma och insulinresistens minskar produktionen av dessa mediatorer, vilket bidrar till vasomotordysfunktion. PVAT har också visats vara involverad i cirkadisk reglering av blodtrycket genom proteinet BMAL1, som reglerar lokal angiotensinogenproduktion och metabolism av vasokonstriktorer såsom noradrenalin.
Oxidativ stress i kärlväggen
Fettvävnad spelar en viktig roll i att reglera kärlens redoxstatus. Ökad oxidativ stress har kopplats till accelererat biologiskt åldrande och negativa kliniska utfall. NADPH-oxidas är en central källa till superoxidanjoner i kärlväggen.
- Skyddande adipokiner: Adiponectin och omentin 1 hämmar aktivering av NOX1 och NOX2 genom att blockera RAC1-aktivering och nedreglera p22phox.
- Pro-oxidativa adipokiner: Leptin och resistin stimulerar oxidativa processer och bidrar till aterogenes.
Endotelial funktion och inflammation
Uncoupling av eNOS till följd av minskad bioaktivitet av BH4 är en viktig mekanism som bidrar till superoxidproduktion. Adipokiner som adiponectin främjar eNOS-fosforylering via AMPK-signalering och förbättrar eNOS-koppling, medan chemerin har motsatt effekt genom att inducera eNOS-uncoupling och minska produktionen av NO till förmån för superoxid.
Pro-inflammatoriska cytokiner från fettvävnad, såsom IL-1β och TNF, samt adipokiner som visfatin, inducerar uttryck av adhesionsmolekyler på endotelceller och förstärker kärlinflammation.
Multifunktionella adipokiner
Adipokiner, såsom leptin, har komplexa och ibland motstridiga effekter beroende på celltyp och sjukdomsförhållanden. Till exempel anses leptinsignalering i endotelet vara skyddande mot neointimaformation, men fetmainducerad leptinresistens kan förskjuta balansen mot en aterogen fenotyp. Centrala signalvägar, såsom NF-κB, spelar en nyckelroll i dessa processer och påverkas av adipokiner som adiponectin (inhiberande) och leptin (aktiverande).
MicroRNA från fettvävnad och kardiovaskulära komplikationer #
MikroRNA (miRNA), små RNA-molekyler som reglerar genuttryck på posttranskriptionell nivå, produceras av fettvävnad och deras profil förändras vid tillstånd som fetma, insulinresistens och kranskärlssjukdom (CAD). MikroRNA är involverade i en rad biologiska processer, inklusive:
- Inflammatorisk cellrekrytering: MikroRNA styr rekryteringen av inflammatoriska celler till dysfunktionell fettvävnad.
- Reglering av insulinkänslighet: Adipose tissue-derived mikroRNA påverkar insulinsignaleringen.
Adipose tissue-derived mikroRNA packas i extracellulära vesiklar, såsom exosomer och mikropartiklar, och frisätts i blodcirkulationen. På detta sätt kan fettvävnad reglera genuttryck i avlägsna vävnader.
MikroRNA och sjukdomsprocesser
MikroRNA är kopplade till flera patologiska tillstånd, inklusive:
- Fettvävnadens brunfärgning
- Inflammation
- Hjärtvävnadsfibros
- Ateroskleros
- Aktivering av vaskulära glatta muskelceller
Experimentella studier visar att exosomer från VAT (visceralt fett) hos möss med fettrik kost inducerar pro-inflammatorisk polarisation av M1-makrofager och accelererar ateroskleros. Däremot har liknande effekter inte observerats hos exosomer från SAT (subkutan fettvävnad) eller VAT från friska möss. Dessa fynd indikerar depåspecifika skillnader i exosomproduktion.
Gasformiga signalämnen och kardiovaskulär reglering #
NO och H₂S
Gasformiga signalmolekyler från fettvävnad, såsom kväveoxid (NO) och vätesulfid (H₂S), spelar en central roll i interaktionen mellan fettvävnad och kardiovaskulära systemet:
- Kväveoxid (NO): Produceras av adipocyter eller makrofager via NOS och utövar parakrina anti-inflammatoriska effekter.
- Vätesulfid (H₂S): Har visat sig reglera vaskulär funktion.
Störd produktion av dessa molekyler vid fetma har kopplats till endotelial dysfunktion och pro-aterogena effekter.
Immunologiska egenskaper hos perivaskulär fettvävnad (PVAT) #
Lokal Immunreglering av PVAT
Lokala immunologiska egenskaper hos PVAT framhävs alltmer som kritiska regulatorer av dess funktion. Flera mekanismer har identifierats:
- Makrofagpolarisation: Reglerar PVAT-funktion och påverkar inflammation.
- PVAT-eosinofiler: Reglerar PVAT:s anti-kontraktila respons.
- B1-celler i PVAT: Utövar ateroskyddande effekter genom produktion av IgM mot oxidationsspecifika epitoper på LDL.
Cytokiner och kemokiner
PVAT-inflammation är associerad med kärldysfunktion vid hypertoni och medierar T-cellinfiltration i det perivaskulära utrymmet via cytokiner och kemokiner, såsom CCL5. Dessutom minskar produktionen av adiponectin via komplementkomponenten C5a, vilket främjar hypertensiv kärlinflammation.
Fettvävnadens och myokardiets kommunikation #
Endokrin och parakrin interaktion mellan fettvävnad och myokardium resulterar i ett kontinuerligt samspel finns mellan myokardiet och fettvävnaden:
- Endokrin signalering: Avlägsna fettvävnadsdepåer kan påverka hjärtats biologi genom att frisätta bioaktiva molekyler i blodomloppet.
- Parakrin signalering: Epikardiell fettvävnad (EAT), som ligger på hjärtats yta innanför det viscerala perikardiet, interagerar direkt med intilliggande kardiomyocyter och extracellulär matrix.
Effekterna av EAT på hjärtats biologi beror på dess sekretom, som innehåller adipocytokiner, mikropartiklar, gasformiga signalämnen och lipider. Faktorer som fetma, systemisk inflammation och insulinresistens kan förändra sekretomet och förskjuta balansen mot skadliga hjärteffekter.
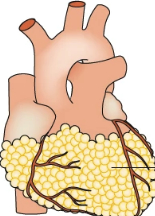
Figuren ovan visar hur ektopisk fettvävnad omger hjärtat hos individer med hög ålder, fetma och typ 2 diabetes. Denna fettdepå tros vara farliga än subkutant och visceralt fett eftersom den friger mer adipocytokiner och ligger i direkt anslutning till hjärtmuskeln
Molekyler och biologiska processer i myokardiet #
Adipose tissue-derived molekyler är inblandade i flera processer i myokardiet:
- Hypertrofi, redoxbalans och kontraktilitet: Molekyler reglerar oxidativ stress och inflammation i myokardiet.
- Inflammation och fibros: Adipokiner som osteopontin och leptin främjar hjärtfibros genom att modulera fibroblastsenescens och oxidativ stress.
- Arrytmogenes och hjärtsvikt: Aktiverande molekyler som RBP4 och chemerin främjar insulinresistens, kardiomyocythypertrofi och apoptos via inflammatoriska signalvägar.
Myokardiets påverkan på EAT
Signalering från myokardiet till EAT sker genom:
- Natriuretiska peptider: Dessa ökar adiponectinbiosyntes och kan inducera brunfärgning av fettvävnaden.
- Oxidativ stress: Lipidperoxidationsprodukter från oxidativ stress i myokardiet aktiverar PPARγ i EAT, vilket ökar adiponectinproduktionen och skyddar myokardiet.
Epikardiell fettvävnad vid hjärtsjukdomar
EAT genomgår fenotypiska, proteomiska och strukturella förändringar vid olika hjärtåkommor:
- Förmaksflimmer: Fibrotiska förändringar i subepikardiell fettvävnad bidrar till förmaksremodellering.
- Hjärtsvikt: Omfattande remodellering av EAT:s extracellulära matrix och ökad lipolys frigör skadliga lipolytiska intermediärer.
Bidirektionellt samspel mellan blodkärl och fettvävnad #
Kärlväggen och PVAT
Tidiga studier har visat att kärlskador kan leda till en uppreglering av pro-inflammatoriska adipocytokiner och nedreglering av adiponectin i perivaskulär fettvävnad (PVAT). Lipidperoxidationsprodukter som 4-hydroxynonenal från kärlväggen aktiverar PPARγ-signalering, vilket ökar adiponectinproduktionen och skyddar kärlväggen genom antioxidativa mekanismer.
Myokardiet och EAT
Liknande signaleringsvägar har upptäckts mellan myokardiet och EAT. Oxidationsprodukter från myokardiet inducerar adiponectinproduktion via PPARγ i EAT, vilket skyddar kardiomyocyter från oxidativ stress. Studier har även visat att natriuretiska peptider stimulerar brunfärgning av fettvävnad, vilket förbättrar energiförbrukning och insulinkänslighet.
Systemiska implikationer
Vid avancerad ateroskleros är nivåerna av B-typ natriuretiska peptider den primära drivkraften för cirkulerande adiponectin, snarare än systemisk inflammation. Lokala inflammatoriska mediatorer från hjärtsjukdomar, såsom systolisk hjärtsvikt, bidrar till lipolys i EAT, vilket kopplats till en minskad vänsterkammarejektionsfraktion.
Antihyperglykemiska läkemedel och fettvävnad #
Flera experimentella terapier som riktar sig mot fettvävnaden har visat kardiovaskulära fördelar i djurmodeller och prekliniska studier. Trots dessa framsteg återstår det stora utmaningar att översätta dessa insatser till säkra, effektiva och kostnadseffektiva behandlingar. Samtidigt har livsstilsförändringar och etablerade läkemedel visat sig förbättra fettvävnadens funktion med påtagliga kardiovaskulära fördelar.
GLP1-agonister och DPP4-hämmare
- GLP1-agonister (t.ex. liraglutid) och DPP4-hämmare har dokumenterade kardiovaskulära fördelar vid typ 2-diabetes. GLP1 är ett inkretin som stimulerar insulinsekretion och hämmar glukagon, medan DPP4 är ett enzym som bryter ner GLP1 och uttrycks i fettvävnaden.
- DPP4-hämmare reglerar M1–M2 makrofagpolarisation i visceralt fett (VAT) och minskar fettvävnadsfibros.
- GLP1-agonister ökar adiponectinproduktion och främjar brunfärgning av vit fettvävnad (WAT).
- Kliniska studier visar att liraglutid snabbt minskar volymen av epikardiell fettvävnad (EAT).
SGLT2-hämmare
- SGLT2-hämmare minskar blodglukos genom att hämma njurens glukosåterupptag och har direkta effekter på fettvävnaden:
- Minskar uttrycket av pro-inflammatoriska kemokiner och ökar insulinkänsligheten.
- Reducerar EAT-volymen, vilket kan bidra till deras kardioprotektiva profil.
PPARγ-agonister och fettvävnad
- PPARγ-agonister, såsom pioglitazon, har visat sig minska inflammationen i PVAT och stabilisera aterosklerotiska plack.
- Dessa läkemedel främjar adipocytdifferentiering, främst i subkutan fettvävnad, vilket skyddar mot VAT-expansion och ektopisk fettinlagring.
- Säkerhetsprofilen för PPARγ-agonister är dock kontroversiell, med tidigare rapporter om ökad risk för CVD med vissa läkemedel i denna klass.
Andra kardiovaskulära läkemedel och fettvävnad
Renin–angiotensin–aldosteronsystemet (RAAS):
- Fettvävnaden producerar angiotensinogen och angiotensin II, vilket bidrar till lokal och systemisk RAAS-aktivering.
- Typ 2-angiotensin II-receptoraktivering främjar brunfärgning av fettvävnad och skyddar mot fetmarelaterade metabola störningar.
Synergistiska effekter
- Atorvastatin: Främjar upptaget av lipoproteinrester genom levern vid aktivering av brun fettvävnad (BAT).
- Metotrexat: Minskar inflammatoriska cytokiner och ökar adiponectinproduktion, vilket förbättrar endotelial funktion.
Livsstilsförändringar: motion och diet
- Kalorirestriktion: Förbättrar vaskulär insulinkänslighet och minskar produktionen av pro-inflammatoriska cytokiner i PVAT.
- Motion: Aerob träning och högintensiv intervallträning minskar VAT och total fettmassa och förbättrar insulinkänslighet och adipokinprofil.
Intermittent fasta
- Periodisk fasta förbättrar termogenes i fettvävnaden och främjar brunfärgning av WAT genom M2-makrofagpolarisation.
Kirurgiska behandlingar: bariatrisk kirurgi
- Bariatrisk kirurgi, exempelvis Roux-en-Y gastric bypass, har långsiktiga fördelar vid fetmarelaterade metabola komplikationer:
- Minskad infiltration av makrofager och T-celler i fettvävnaden.
- Ökade nivåer av adiponectin och minskad lipolys samt fettcellstorlek.
- Kirurgin förbättrar hyperglykemi genom ökad GLP1-produktion och stimulerad insulinsekretion.



