Hur semaglutid påverkar kroppens proteiner och biologiskt åldrande
Introduktion
Förekomsten av fetma fortsätter att öka globalt. Antalet individer som lever med fetma beräknas nästan fördubblas från cirka en miljard år 2020 till över två miljarder år 2035. Nya uppskattningar tyder dock på att dessa prognoser kan komma att revideras nedåt, särskilt i ljuset av utvecklingen av nya och effektiva farmakologiska behandlingsalternativ. Samtidigt är det i dagsläget osäkert i vilken utsträckning dessa behandlingar kommer att initieras och bibehållas över tid i den breda befolkningen.
Fetma och övervikt utgör därmed några av de viktigaste riskfaktorerna för multimorbiditet, med omfattande negativa konsekvenser för metabol och kardiovaskulär hälsa samt för både psykiskt och fysiskt välbefinnande. Tillstånden är även associerade med en ökad risk för förtida död.
Under senare år har betydande framsteg gjorts inom behandlingen av fetma genom livsstilsinriktade beteendeförändringar, farmakologiska behandlingar, metabol bariatrisk kirurgi och olika kombinationer av dessa insatser. I takt med dessa framgångar har behovet av att identifiera och utveckla ytterligare, mer effektiva behandlingsstrategier mot fetma blivit allt tydligare.
Proteomik
Proteomik innebär studier av proteiners struktur och funktion i stor skala med hjälp av tekniker som möjliggör samtidig analys av mycket omfattande datamängder. Metoden kan bidra till en fördjupad förståelse av sjukdomars patofysiologi, klargöra verkningsmekanismer för befintliga behandlingar, möjliggöra utveckling av biomarkörer för att förutsäga behandlingssvar och sjukdomsförlopp samt identifiera potentiella nya terapeutiska mål.
SomaScan är en proteomikplattform som använder korta, DNA-liknande molekyler för selektiv bindning till specifika proteiner. Plattformen var den första högkapacitetsmetoden som möjliggjorde samtidig kvantifiering av tusentals proteiner från mycket små provvolymer i storskaliga populations- och kliniska studier.
Viktnedgång till följd av kostbaserade interventioner och bariatrisk kirurgi är förenad med förändringar i det cirkulerande proteomet, särskilt avseende proteiner involverade i inflammatoriska och metabola signalvägar.
Semaglutid (Ozempic, Wegovy och Rybelsus)
Semaglutid är en långtidsverkande GLP-1-analog och har förmågan att sänka HbA1c genom att öka glukosberoende insulinfrisättning, minska utsöndringen av glukagon samt fördröja magtömning. GLP-1-receptoragonister har även en direkt påverkan på aptitreglering via hjärnan, vilket bidrar till viktnedgång.
STEP 1 studien
I den randomiserade kliniska studien STEP 1 (Semaglutide Treatment Effect in People with Obesity), som inkluderade 1961 vuxna med övervikt eller fetma utan typ 2 diabetes, ledde behandling med semaglutid 2,4 mg till en betydligt större viktnedgång jämfört med placebo under 68 veckor. Hälften av deltagarna som behandlades med semaglutid uppnådde en viktnedgång på minst 15%, jämfört med knappt 5% i placebogruppen.
STEP 2 studien
I STEP 2-studien inkluderades 1210 vuxna med övervikt eller fetma och typ 2 diabetes, observerades även där en signifikant större viktnedgång med semaglutid jämfört med placebo efter 68 veckors behandling.
Forskare på Novo Nordisk har genomfört dessa kliniska läkemedelsprövningar och även analyserat fastande serumprover insamlade vid studiestart och i slutet på studierna från ett stort urval av deltagare i de randomiserade placebokontrollerande studierna. Syfter var att undersöka hur behandling med semaglutid påverkade det cirkulerande proteomet.
Figuren nedan är tagen från studien som publicerades i Nature Medicine, titel “Proteomic changes upon treatment with semaglutide in individuals with obesity”, https://doi.org/10.1038/s41591-024-03355-2, Maretty L et al.
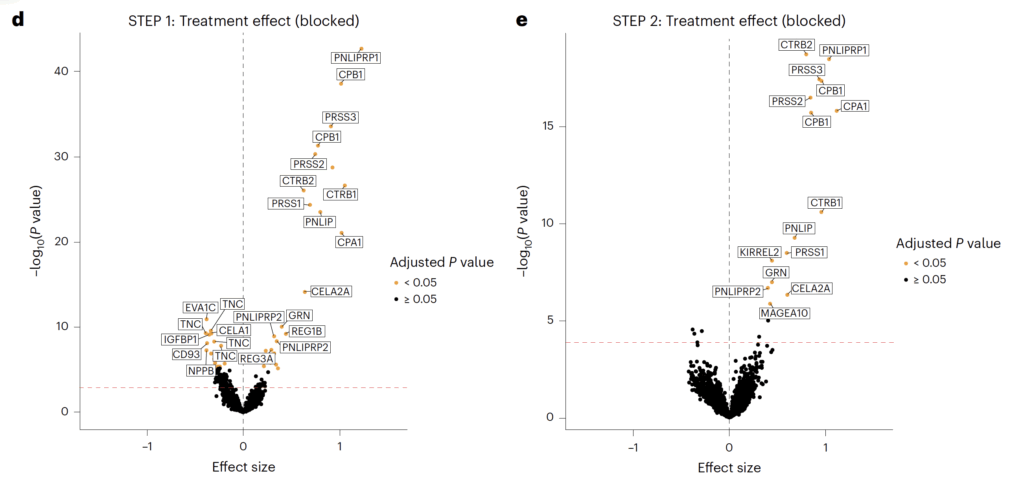
I STEP 1 identifieras ett stort antal proteiner som förändras signifikant jämfört med placebo. De mest framträdande nedreglerade proteinerna är kopplade till fettmassa, systemisk inflammation och kardiovaskulär stress, medan de mest kraftigt uppreglerade proteinerna huvudsakligen tillhör exokrina pankreasenzym.
Panel A
Viktiga nedreglerade proteiner i STEP 1
- LEP (leptin) – adipokin som speglar fettmassa och energilager
- CRP (C-reaktivt protein) – systemisk inflammationsmarkör
- NPPB / NT-proBNP (natriuretisk peptid B) – markör för myokardiell väggstress
- TNC (tenascin C) – extracellulär matrix-protein kopplat till fibros och kardiovaskulär risk
- THBS2 (trombospondin-2) – extracellulär matrix och vaskulär remodellering
- ANGPT2 (angiopoietin-2) – endotelial dysfunktion och kärlombyggnad
- CD93 – vaskulär homeostas och inflammation
- MSR1 (makrofag scavenger receptor 1) – lipidupptag och inflammatorisk aktivering
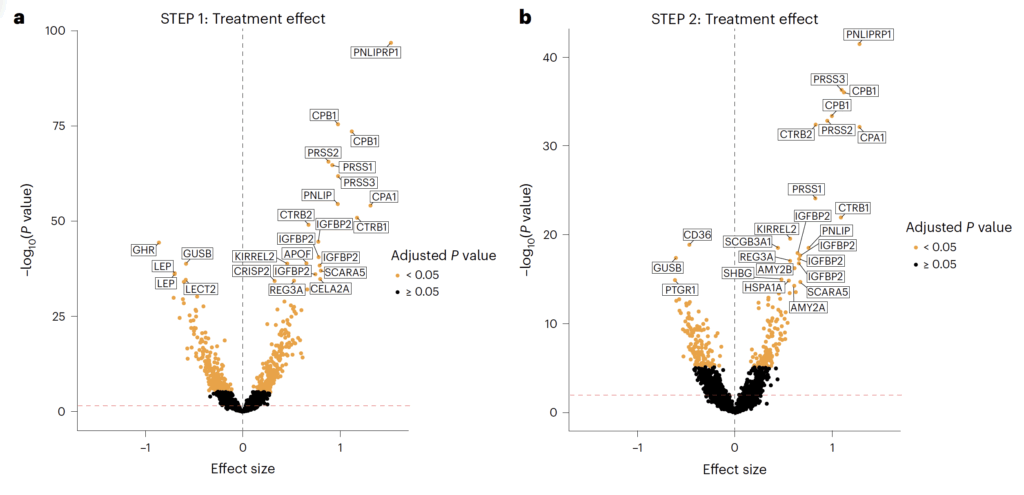
Figuren visar att behandling med semaglutid under 68 veckor leder till omfattande och systematiska förändringar i det cirkulerande proteomet hos individer med obesitas, både utan typ 2 diabetes (STEP 1) och med typ 2 diabetes (STEP 2). Förändringarna omfattar proteiner involverade i adipocyter, inflammation, kardiovaskulär belastning, lipidmetabolism, hormonell reglering samt pankreas exokrina funktion.
Viktiga uppreglerade proteiner i STEP 1
Dessa domineras av exokrina pankreasenzymer. Denna uppreglering överensstämmer med kända GLP-1-receptoragonisteffekter på pankreas och betraktas som en farmakologisk signatur snarare än ett patologiskt fynd.
- PRSS1, PRSS2, PRSS3 (trypsiner) – proteinnedbrytning
- CTRB1, CTRB2 (chymotrypsiner) – proteolys
- PNLIP, PNLIPRP1, PNLIPRP2 (pankreaslipaser) – fettspjälkning
- AMY2A, AMY2B (alfa-amylas) – kolhydratspjälkning
- CPA1, CPB1 (karboxypeptidaser) – proteinnedbrytning
Panel B
I STEP 2 ses ett liknande men kvantitativt svagare mönster. Samma biologiska processer påverkas, men färre proteiner uppnår statistisk signifikans efter statistisk korrigering. Detta bedöms bero på mindre viktminskning, större metabol heterogenitet och lägre statistisk styrka. Trots detta är riktningen av förändringarna överensstämmande med STEP 1, vilket talar för gemensamma biologiska mekanismer.
Sammantaget indikerar figuren att semaglutid inte enbart verkar genom viktminskning och förbättrad glykemisk kontroll, utan även uppvisar biologiska effekter som delvis är oberoende av dessa mekanismer.
Panel C
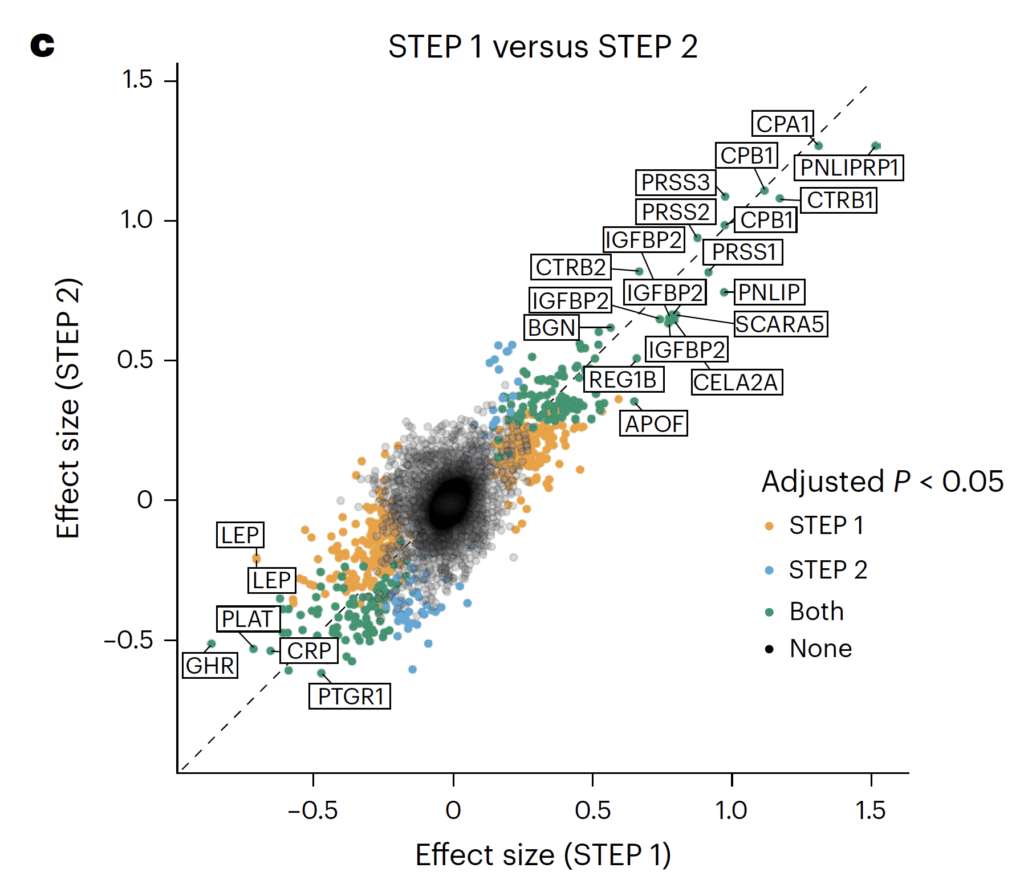
Överlapp och skillnader mellan STEP 1 och STEP 2
Panel C visar en stark positiv korrelation mellan effektstorlekar i STEP 1 och STEP 2. Detta innebär att de flesta proteiner förändras i samma riktning i båda studierna.
Proteiner med tydlig överlapp mellan STEP 1 och STEP 2
- LEP (leptin)
- CRP (C-reaktivt protein)
- NPPB / NT-proBNP
- TNC (tenascin C)
- ANGPT2 (angiopoietin-2)
- Exokrina pankreasenzymer (PRSS-, CTRB-, PNLIP-familjerna)
Skillnaderna mellan studierna är därför i huvudsak kvantitativa, inte kvalitativa.
Effekter efter justering för BMI och HbA1c-förändringar
När analysen justeras för både kroppsvikt och HbA1c isoleras de proteiner vars förändring inte kan förklaras av viktminskning eller förbättrad glykemisk kontroll.
Panel D
STEP 1 – Proteiner som kvarstår efter justering
Följande proteiner förblir signifikant reglerade och representerar sannolika direkta effekter av semaglutid:
- NPPB / NT-proBNP – minskad kardiell belastning
- TNC (tenascin C) – minskad extracellulär matrix-remodellering
- THBS2 (trombospondin-2) – fibros och vaskulär struktur
- ANGPT2 (angiopoietin-2) – förbättrad endotelial funktion
- CD93 – kardiovaskulär homeostas
- sFRP4 (secreted frizzled-related protein 4) – kopplad till insulinresistens och betacellsdysfunktion
- LFABP (lever fatty acid-binding protein) – hepatisk lipidhantering
- GRN (granulin) – neuroinflammation, lysosomal funktion, neurodegeneration
Dessa fynd är särskilt viktiga eftersom flera av dessa proteiner är etablerade riskmarkörer för kardiovaskulär sjukdom.
Panel E
I STEP 2 kvarstår endast: MAGEA10 (melanoma-associated antigen 10A) som är ett cancer/testis-antigen med oklar metabol roll
Den begränsade mängden kvarvarande signaler tolkas främst som en effekt av reducerad statistisk styrka snarare än avsaknad av viktoberoende biologi.
Molekylära processorer som är involverade
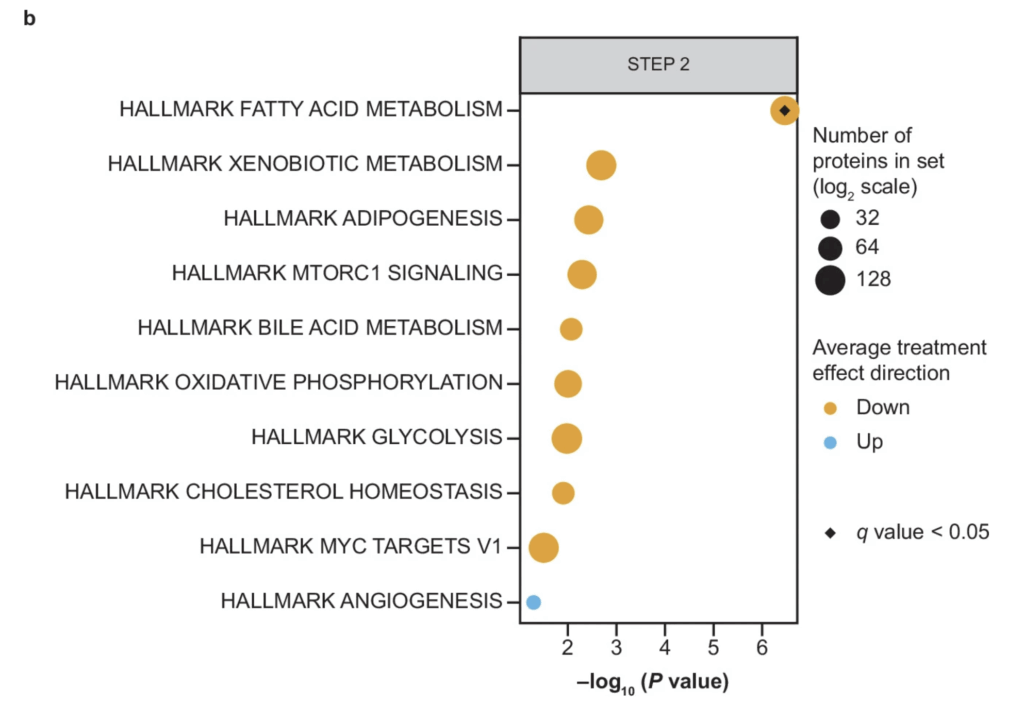
Figurerna nedan illustrerar de molekylära processer på gruppnivå som påverkas vid behandling med semaglutid i STEP 1- och STEP 2-studierna. Tillsammans belyser dessa figurer flera centrala biologiska mekanismer som kan förklara en betydande del av de kliniska effekter som observeras vid behandling med GLP-1-receptoragonister. Bland de mest framträdande processerna återfinns fettsyrametabolism, mTORC1-signalering, xenobiotisk metabolism (nedbrytning och omsättning av främmande kemiska ämnen) samt adipogenes.
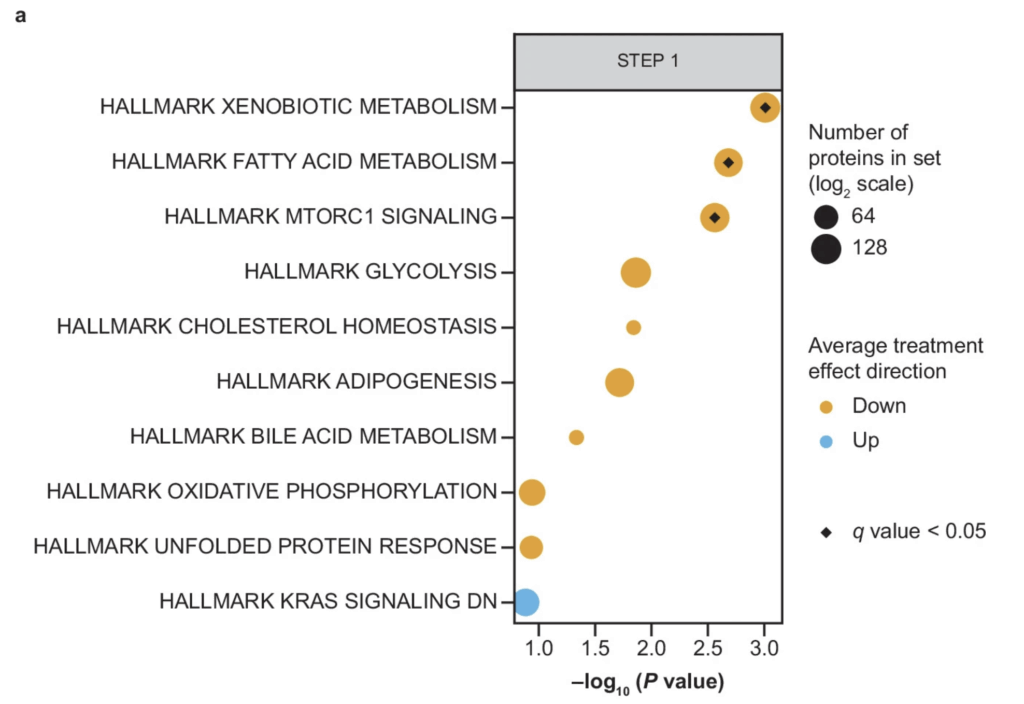
Fettsyrametabolism
Fettsyrametabolism omfattar de processer genom vilka fettsyror syntetiseras, lagras, mobiliseras och oxideras för energiproduktion. Förändringar inom denna signalväg speglar hur behandlingen påverkar kroppens förmåga att utnyttja fett som energikälla och minska patologisk fettinlagring, särskilt i lever och fettväv.
mTORC1
mTORC1 (mechanistic target of rapamycin complex 1) är ett centralt cellulärt signaleringskomplex som fungerar som en närings- och energisensor. mTORC1 integrerar signaler från tillgängliga näringsämnen, insulin och andra tillväxtfaktorer för att reglera proteinsyntes, lipidsyntes, celltillväxt och energiförbrukning.
En nedreglering av mTORC1-aktivitet är ofta kopplad till förbättrad metabol flexibilitet, ökad autofagi och minskad lipogenes, vilket är gynnsamt vid tillstånd som obesitas och insulinresistens. Att mTORC1-relaterade signalvägar påverkas vid GLP-1-behandling indikerar att effekterna sträcker sig bortom aptitreglering och även omfattar grundläggande cellulära energiprocesser.
Adipogenes
Adipogenes avser differentiering och nybildning av fettceller samt hur fettvävnad expanderar och omstruktureras. Förändringar i adipogena signalvägar kan bidra till en mer metabolt gynnsam fettväv med förbättrad insulinrespons och minskad inflammation.
Xenobiotisk metabolism representerar kroppens system för att bryta ner och eliminera främmande ämnen, inklusive läkemedel och miljökemikalier, främst via levern. Att denna process påverkas tyder på breda metabola anpassningar och förändringar i leverns enzymatiska kapacitet under behandling.
Sammantaget visar dessa molekylära analyser att fettsyrametabolism, mTORC1-signalering och adipogenes är tätt sammankopplade processer som reglerar hur kroppen lagrar, omsätter och förbrukar energi. Resultaten pekar på att just metabola och energirelaterade signalvägar utgör en central drivkraft bakom många av de gynnsamma effekter som observeras vid behandling med GLP-1-baserade läkemedel.
Proteiner som förändras vid behandling med semaglutid
Biologiskt består signaturen av tre huvudsakliga komponenter. För det första ses en nedreglering av proteiner kopplade till fettmassa, inflammation och kardiovaskulär belastning, såsom leptin (LEP, adipositetsmarkör), GHR (tillväxthormonreceptor, energimetabolism) och PLAT (vävnadsplasminogenaktivator, vaskulär ombyggnad). För det andra ses en tydlig uppreglering av exokrina pankreasenzymer, inklusive trypsiner (PRSS1–3), chymotrypsiner (CTRB1/2), lipaser (PNLIP, PNLIPRP1) och karboxypeptidaser (CPA1, CPB1). För det tredje ingår proteiner relaterade till lipid- och tillväxtsignalering, exempelvis APOF (apolipoprotein F) och IGFBP2 (insulin-like growth factor-bindande protein 2).
Det är viktigt att understryka att dessa proteiner inte är avsedd att förutsäga kliniskt behandlingssvar, såsom graden av viktnedgång eller förbättring av HbA1c. I stället förutsäger den biologisk exponering för semaglutid. Med hög träffsäkerhet (AUC ~0,94 i STEP 1 och ~0,93 i STEP 2) kan modellen, baserat enbart på blodproteiner, avgöra om en individ har behandlats med semaglutid eller placebo.
Signaturen representerar därmed ett mekanistiskt fingeravtryck av semaglutid i cirkulationen. Dess värde ligger i att bekräfta läkemedlets biologiska specificitet, särskilja farmakologiska effekter från generell viktnedgång och skapa en plattform för framtida analyser, såsom studier av följsamhet, jämförelser mellan olika inkretinbaserade terapier och utforskning av potentiella nya indikationer.
Biologiskt åldrande
En artikel som studerar just biologiskt åldrande och GLP-1 är “Epigenetic Aging and Treatment Response to Semaglutide in the SLIM LIVER Study”
Metoder
Studien är en post hoc-analys av SLIM LIVER-studien, en öppen, enarmad fas 2-studie där personer med hiv (PWH) och metabolt dysfunktionsassocierad steatotisk leversjukdom (MASLD) behandlades med semaglutid 1,0 mg subkutant en gång per vecka i 24 veckor.
Den epigenetiska delstudien inkluderade 41 deltagare med tillgängliga perifera mononukleära blodceller (PBMC) vid både baseline och vecka 24. DNA extraherades från PBMC, bisulfitbehandlades och analyserades med Illumina HumanMethylationEPIC BeadChip (≈850 000 CpG-siter). Data förprocessades med etablerade bioinformatiska pipelines (minfi, ENmix).
Epigenetiska metoder (och hur de skiljer sig)
Tre DNA-metyleringsbaserade epigenetiska åldersmarkörer användes:
- DunedinPACE– En tredje generationens epigenetisk klocka som mäter åldrandets hastighet (“pace of aging”), snarare än ackumulerad biologisk ålder.– Känslig för korttidsförändringar och särskilt relevant för interventionsstudier.
- PCGrimAge– En principal component-baserad version av GrimAge som estimerar biologisk ålder och mortalitetsrisk.– Mer stabil, långsiktig markör för risk snarare än snabb behandlingsrespons.
- PCDNAmTL– En metyleringsbaserad uppskattning av telomerlängd.– Reflekterar cellulär åldrande och kopplas ofta till fysisk funktion och biologisk resiliens.
Deltagarna stratifierades utifrån riktningen på förändringen (ökning vs minskning) i respektive markör.
Deltagarna var ≥18 år, levde med välkontrollerad hiv (HIV-RNA <50 kopior/mL), hade ≥5 % leverfett mätt med MRI-PDFF, central adipositas samt insulinresistens eller prediabetes. Personer med diabetes, signifikant alkoholkonsumtion eller annan leversjukdom exkluderades.
Resultat
På gruppnivå var de epigenetiska åldersmarkörerna överlag stabila över 24 veckor. Däremot sågs kliniskt relevanta samband när man analyserade individuella förändringar:
- Minskning i DunedinPACE (≈42 % av deltagarna) var signifikant associerad med större reduktion av leverfett (IHTG) jämfört med dem med ökad DunedinPACE (p=0,024).
- Dessa individer visade även en trend mot förbättrad gånghastighet.
- Ökad PCDNAmTL (≈49 %) var signifikant associerad med förbättrad gånghastighet (p=0,012) och en trend mot större HbA1c-sänkning.
- PCGrimAge visade inga tydliga samband med metabola eller antropometriska utfall.
Viktminskning, BMI, HOMA-IR och lipider förbättrades generellt med semaglutid men var inte beroende av epigenetisk respons, vilket tyder på att vissa biologiska åldrandeprocesser är mer organspecifika.
Figuren nedan visar att förändring i DunedinPACE – men inte PCGrimAge eller PCDNAmTL – selektivt identifierar de individer som får störst minskning av leverfett efter semaglutidbehandling. Detta är studiens centrala fynd och stöder hypotesen att åldrandets hastighet, snarare än kronologisk eller kumulativ biologisk ålder, är kopplad till leverns behandlingsrespons.
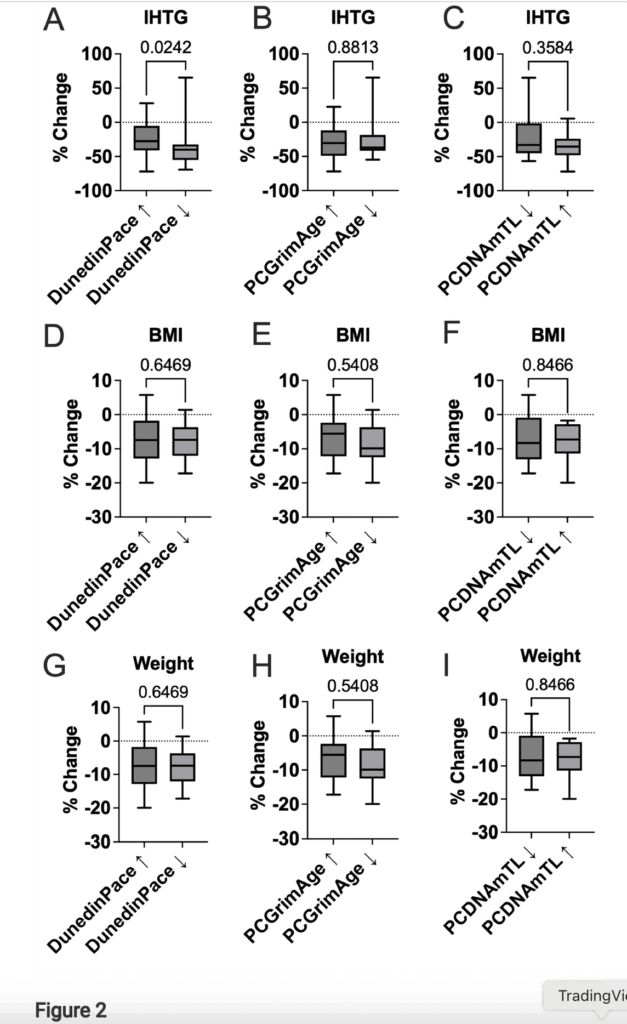
Figuren etablerar därmed DunedinPACE som en potentiell prediktiv biomarkör för organspecifik effekt av GLP-1-behandling.
Proteiner, leversjukdom och GLP-1
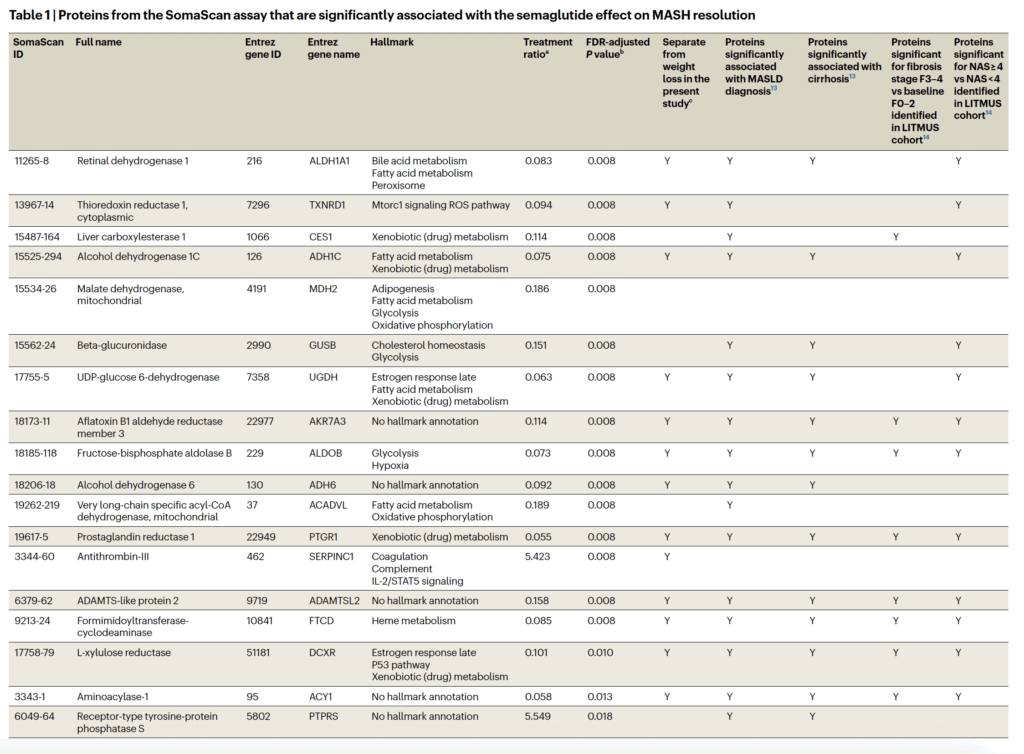
“Modulation of metabolic, inflammatory and fibrotic pathways by semaglutide in metabolic dysfunction-associated steatohepatitis”, som publicerades i Nature Medicine visar vilka proteiner som förändras, hur de mäts och vad de biologiskt betyder.
Metoder
Studien kombinerar kliniska data från en fas 2-studie av semaglutid vid MASH (metabolic dysfunction–associated steatohepatitis) med prekliniska djurmodeller och storskalig serumproteomik.
I den kliniska delen analyserades serum från patienter med biopsiverifierad MASH som behandlats med semaglutid (0,1–0,4 mg dagligen) eller placebo under 72 veckor. För att studera biologiska mekanismer användes aptamerbaserad proteomik (SomaScan), som samtidigt mäter ~5 000 cirkulerande proteiner i blod. Analysen inkluderade både:
- Fördefinierade SomaSignal-tester kopplade till leverhistologi (steatos, inflammation, ballooning, fibros)
- Explorativ data mining (LASSO-regression, mediatoranalyser och mixed models)
Parallellt genomfördes studier i två etablerade musmodeller för MASH (DIO-MASH och CDA-HFD) för att analysera fibros, genuttryck och leverhistologi.
Proteomiska metoder – hur proteinerna identifieras
- SomaSignal NASH-panelerValiderade proteinpaneler som speglar histologiska komponenter i MASH:
- Steatos (12 proteiner)
- Lobulär inflammation (14 proteiner)
- Hepatocyt-ballooning (5 proteiner)
- Fibros (8 proteiner)
- Global proteomanalys (SomaScan 5k)Alla ~4 979 mätta proteiner analyserades för behandlingseffekt.
- 279 proteiner ändrades signifikant av semaglutid vs placebo
- En 14-proteiners behandlingssignatur identifierades som mest känslig för semaglutid
- En 72-proteiners “treatmentsignatur” identifierades som statistiska mediatorer för MASH-resolution
- MediationsanalysAnvändes för att avgöra vilka proteinförändringar som är:
- Viktförlustberoende
- Potentiellt delvis oberoende av viktförlust (26 proteiner)
Resultat – vilka proteiner förändras och hur
Övergripande mönster
Semaglutid normaliserar den cirkulerande proteomprofilen vid MASH, så att den närmar sig mönstret hos friska individer. Effekten är dosberoende och starkast för steatos och inflammation, men även tydlig för fibros.
Viktiga proteinförändringar (exempel)
Proteiner som minskar med behandling (förhöjda vid MASH):
- ADAMTSL2 – extracellulär matrix, fibros, kopplad till hjärt- och leverfibros
- ACY1 – starkt associerad till MASLD/MASH och framtida T2D-risk
- AKR1B10 – oxidativ stress, leverinflammation
- CFHR4, TREM2 – inflammation, makrofagaktivitet, fibros
Proteiner som ökar med behandling (sänkta vid MASH):
- SERPINC1 (antitrombin III) – koagulation, tumörsupprimerande roll vid HCC
- APOF – lipid- och lipoproteinmetabolism
- SHBG – metabol och hormonell hälsa
Viktigt fynd
Av de 72 proteinerna kvarstod 26 proteiner som signifikant associerade med MASH-resolution även efter justering för viktförlust, vilket talar för direkta biologiska effekter bortom viktminskning.
Den jämför:
- Proteinhalter hos friska individer
- Proteinhalter hos MASH-patienter
- Förändringar hos MASH-patienter behandlade med semaglutid
Figuren visar tydligt att:
- Proteiner som är förhöjda vid MASH sjunker med semaglutid
- Proteiner som är låga vid MASH ökar med semaglutid➡️ Semaglutid reverserar MASH-associerade proteomförändringar mot ett friskt mönster
Detta är första gången en behandlingsassocierad proteomisk signatur för MASH-resolution har identifierats.
Studien visar att semaglutid inte enbart förbättrar MASH genom viktminskning, utan också genom systemiska förändringar i metabola, inflammatoriska och fibrotiska signalvägar, mätbara i blod. De identifierade proteinerna utgör potentiella:
- Biomarkörer för behandlingssvar
- Mekanistiska länkar mellan MASH, kardiovaskulär sjukdom och metabolism
- Framtida terapeutiska mål
Sammanfattning: vad proteinerna avslöjar om semaglutids biologiska effekter
Analyser av blodproteiner visar att behandling med semaglutid leder till tydliga och systematiska biologiska förändringar i kroppen, utöver själva viktminskningen. Genom att mäta tusentals proteiner i blodet före och efter behandling kan forskarna identifiera vilka biologiska processer som påverkas och vilka organ som svarar på behandlingen.
En central observation är att flera proteiner som normalt är förhöjda vid fetma och metabol sjukdom minskar tydligt vid semaglutidbehandling. Dit hör bland annat leptin, som speglar mängden kroppsfett, CRP som är ett mått på systemisk inflammation, samt NT-proBNP som relaterar till belastning på hjärtat. Även proteiner kopplade till blodkärlens funktion och vävnadsombyggnad, såsom tenascin C, trombospondin-2 och angiopoietin-2, minskar. Tillsammans tyder detta på minskad inflammation, förbättrad kärlfunktion och lägre belastning på hjärta och kärlsystem.
Samtidigt ses en tydlig ökning av proteiner som kommer från bukspottkörtelns exokrina del, till exempel enzymer som trypsiner, chymotrypsiner, lipaser och amylas. Dessa proteiner deltar i nedbrytning av fett, protein och kolhydrater i tarmen. Ökningen tolkas inte som ett tecken på sjukdom, utan som en farmakologisk effekt av GLP-1-behandling som speglar ökad stimulering av pankreas funktion.
Vid mer fördjupad analys framträder flera grundläggande biologiska mekanismer. Proteiner relaterade till fettsyremetabolism förändras, vilket visar att kroppen blir bättre på att använda fett som energikälla och lagra mindre fett på ett skadligt sätt. Signalvägar kopplade till mTORC1, som fungerar som cellernas närings- och energisensor, dämpas. Detta är gynnsamt eftersom lägre mTORC1-aktivitet är kopplad till förbättrad metabol flexibilitet, minskad nybildning av fett och bättre cellhälsa. Även adipogenes, processen som styr hur fettceller bildas och fungerar, påverkas i en riktning som främjar en mer hälsosam fettväv.
När analysen justeras för både viktminskning och förbättrat blodsocker kvarstår flera proteinförändringar, särskilt de som är kopplade till hjärta, kärl, lever och inflammation. Detta visar att semaglutid har direkta biologiska effekter som inte enbart kan förklaras av att man går ner i vikt.