Anpassning till metaboliskt status
För att säkerställa att insulinnivåerna i blodet är lämpliga för det rådande metaboliska tillståndet är β-celler utrustade med mekanismer för att:
- Upptäcka förändringar i cirkulerande näringsämnen.
- Registrera hormonnivåer.
- Reagera på aktiviteten i det autonoma nervsystemet.
Säkerhetsmekanismer för korrekt insulinsvar
β-celler har dessutom inbyggda säkerhetsmekanismer som koordinerar inkommande signaler och ser till att insulinsvaret blir korrekt.
Faktorer som påverkar insulinsekretion #
Näringsämnen som huvudreglerare
Den viktigaste fysiologiska faktorn för insulinsekretion hos människor är koncentrationen av cirkulerande:
- Glukos.
- Aminosyror.
- Fettsyror.
Dessa näringsämnen har förmågan att initiera en insulinsekretorisk respons. När näringsämnen absorberas från mag-tarmkanalen:
- Registrerar β-cellerna förändringar i näringsnivåerna i blodet.
- Frisätter insulin för att möjliggöra upptag, metabolism eller lagring av näringsämnen i målvävnader.
Minskad insulinsekretion vid näringsbrist
När nivåerna av cirkulerande näringsämnen minskar registreras detta av β-cellerna, som stänger av insulinproduktionen för att förhindra hypoglykemi.
Modifikationer av insulinsekretionen #
Hormoner och neurotransmittorer
β-cellernas svar på näringsstimulerad insulinsekretion kan modifieras av olika:
- Hormoner.
- Neurotransmittorer.
Dessa substanser kan förstärka eller, i vissa fall, hämma den näringsinducerade responsen.
Normoglykemiska förhållanden
Under normoglykemiska förhållanden har dessa substanser liten eller ingen effekt på insulinsekretionen. Detta är en skyddsmekanism som förhindrar olämpliga insulinresponser.
Icke-näringsregulatorer av insulinsekretion #
| Stimulatorer | Inhibitorer |
| Langerhanska ö-celler | |
| Glukagon | SST-14 |
| Adenine nukleotider | Ghrelin |
| Divalenta katjoner | |
| Neurotransmittorer | |
| Acetylkoline | Noradrenalin |
| VIP | Dopamin |
| PACAP | NPY |
| GRP | Galanin |
| Gastrointestinala hormoner | |
| CCK | SST-28 |
| GIP | Ghrelin |
| GLP-1 | |
| Adipokiner | |
| Adiponektin | Leptin, Resistin |
Näringsinducerad insulinsekretion
Näringsmetabolism och β-cellernas roll
Pankreas β-celler reagerar på små förändringar i extracellulära glukoskoncentrationer inom ett smalt fysiologiskt intervall. Mekanismerna genom vilka β-celler kopplar förändringar i näringsmetabolism till reglerad exocytos av insulin blir alltmer väl förstådda.
Glukostransport och β-cellernas glukossensor
Glukos transporteras in i β-cellerna via högkapacitetsglukostransportörer (GLUT; GLUT2 hos gnagare, GLUT1, 2 och 3 hos människor), vilket möjliggör en snabb jämvikt mellan extracellulära och intracellulära glukoskoncentrationer.
När glukos väl är inne i β-cellen fosforyleras det av glukokinas, som fungerar som en “glukosensor” och kopplar insulinsekretionen till den aktuella glukosnivån. Aktiviteten hos glukokinas är avgörande för att reglera glukosinducerad insulinfrisättning.
Glukosens effekt på insulinsekretion
Dos-responskurva
Dos-responskurvan för glukosinducerad insulinfrisättning från isolerade Langerhanska öar är sigmoidal. Kurvan påverkas huvudsakligen av glukokinasets aktivitet:
- Glukosnivåer under 5 mmol/L: Ingen påverkan på insulinfrisättningen.
- Glukosnivåer mellan 5 och ∼15 mmol/L: Insulinfrisättningen ökar progressivt.
- Halvmaximal stimulering: Uppnås vid ∼8 mmol/L glukos.
Tidsförlopp för insulinsekretionen
Vid förhöjda glukosnivåer är insulinsekretionens tidsförlopp karakteriserat av en initial snabb frisättning följt av en mer långsam, ihållande fas.
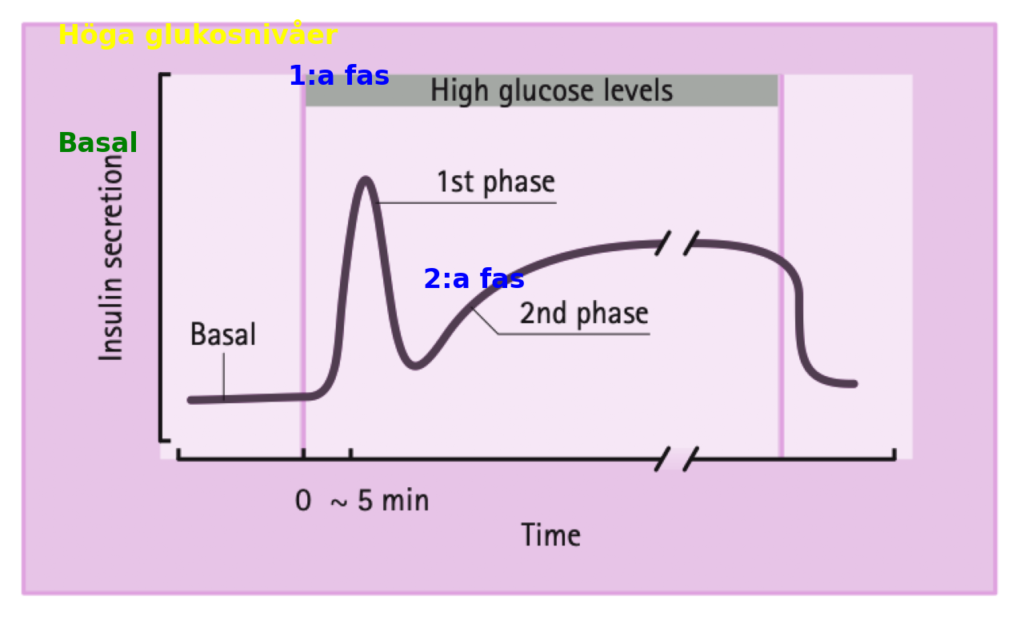
En snabbt stigande men övergående första fas följs av en bibehållen och förlängd andra fas, som visas i figuren ovan. Denna profil för insulinsekretion erhålls både när insulinnivåerna mäts efter en glukosbelastning in vivo och när sekretionsutflödet från ett perfunderat pankreas eller isolerade Langerhanska öar bedöms. Detta tyder på att det karaktäristiska bifasiska sekretionsmönstret är en inneboende egenskap hos de Langerhanska öarna.
ATP-känsliga kaliumkanaler och membrandepolarisering #
Kaliumkanalernas roll i β-celler
I frånvaro av extracellulärt glukos hålls β-cellens membranpotential nära kaliumjämviktspotentialen genom utflödet av kaliumjoner via inåtriktande kaliumkanaler. Dessa kanaler, kallade ATP-känsliga kaliumkanaler (KATP-kanaler), stängs när ATP binder till deras cytosoliska yta, vilket kopplar glukosmetabolism till insulinsekretion.
Mekanism för insulinfrisättning
När glukos metaboliseras i β-cellen ökar ATP-nivåerna medan ADP-nivåerna minskar, vilket leder till att KATP-kanalerna stängs. Detta minskar kaliumutflödet, depolariserar membranet och öppnar spänningsberoende kalciumkanaler. Det resulterande inflödet av kalciumjoner utlöser exocytos av insulinsekretoriska granuler och initierar insulinfrisättning.
Kalium ATP-kanaler som mål för läkemedel
Sulfonylureor och deras effekt
Sulfonylureor stänger KATP-kanaler och är effektiva vid typ 2-diabetes, där β-celler inte svarar tillräckligt på glukos. De bypassar glukosmetabolismens normala koppling till insulinsekretion.
Struktur och funktion
KATP-kanalen är en hetero-oktamerenhet bestående av:
- Fyra Kir6.2-subenheter: Bildar poren för kaliumflöde.
- Fyra SUR1-subenheter: Reglerar kanalens aktivitet.
ATP och sulfonylureor binder till Kir6.2 och SUR1 för att stänga kanalen, medan ADP och diazoxid öppnar den genom att binda till SUR1.
KATP-kanaler och sjukdom
Typ 2-diabetes och genetiska polymorfismer
Stora studier har kopplat polymorfismer i gener som kodar för Kir6.2 och SUR1 till ökad risk för typ 2-diabetes.
Neonatal diabetes och PHHI
Hyperinsulinemisk hypoglykemi hos spädbarn (PHHI): Förlust av funktion hos KATP-kanaler leder till överdriven insulinsekretion trots hypoglykemi. Mutationer i Kir6.2 och SUR1 har kopplats till detta tillstånd och dess svåra glukosobalans.
Permanent neonatal diabetes (PNDM): Aktiverande mutationer i Kir6.2 har visat sig orsaka PNDM, där sulfonylureor kan ge glykemisk kontroll utan insulin.
Kalcium och andra intracellulära effektorer
Kalciumets roll i insulinsekretion
Intracellulärt kalcium är en huvudfaktor för näringsinducerad insulinfrisättning, då det kopplar depolarisering till exocytos av insulinsekretoriska granuler. En kraftig elektrokemisk koncentrationsgradient (∼10 000-faldig) av kalcium bibehålls över β-cellens plasmamembran med hjälp av kalciumextruderande system och aktiv kalciuminlagring i intracellulära organeller.
Kalciumflöde och insulinsekretion
Spänningsberoende kalciumkanaler
Kalciumkoncentrationen i β-celler ökar huvudsakligen genom inflöde av extracellulärt kalcium via spänningsberoende l-typ-kalciumkanaler, som öppnas vid membrandepolarisering. Varje β-cell har uppskattningsvis omkring 500 l-typ-kanaler.
Experimentella observationer
Studier med permeabiliserade β-celler visar att ökningar i intracellulärt kalcium ensamt kan initiera insulinsekretion. Blockering av kalciuminflödet, antingen genom att ta bort extracellulärt kalcium eller farmakologisk inhibering av kalciumkanaler, förhindrar näringsinducerad insulinfrisättning.
Signalvägar kopplade till kalcium
Fosfolipas C och second messengers
Glukos och andra näringsämnen aktiverar kalciumberoende fosfolipas C (PLC) i β-celler, vilket genererar:
- Inositol 1,4,5-trisfosfat (IP3): Snabb mobilisering av intracellulärt kalcium.
- Diacylglycerol (DAG): Verkar som en second messenger.
Dessa förstärker cytosolens kalciumökningar, även om deras roll i insulinsekretionen troligen är modulativ.
Kalciumberoende proteinkinaser
Reglering av insulinsekretion
Kalciumreglerade proteinkinaser transducerar ökningar i intracellulärt kalcium till reglerad insulinsekretion. Dessa inkluderar:
- CaMKs (Kalcium/Calmodulin-beroende kinaser): Aktiveras i närvaro av kalcium och calmodulin och spelar en nyckelroll i insulinfrisättningen vid glukosstimulering.
cPLA2 och arakidonsyra
Cytosoliskt fosfolipas A2 (cPLA2) är en kalciumkänslig enzym som aktiveras vid höga kalciumnivåer och frigör arakidonsyra (AA) från membranlipider. AA kan:
- Stimulera insulinfrisättning oberoende av glukos och kalcium.
- Metaboliseras vidare till prostaglandiner, tromboxaner och leukotriener via COX- och LOX-vägarna.
Arakidonsyra och dess derivat
Oklara roller i β-cellfunktionen
Trots att AA-derivat potentiellt påverkar insulinsekretion är deras exakta funktion osäker. Experimentella studier har begränsats av användningen av ospecifika COX- och LOX-inhibitorer, vilket gör ytterligare forskning nödvändig.
Kalcium och andra intracellulära mekanismer
Kalciums roll i exocytos och signalering
Kalcium är avgörande för insulins exocytotiska frisättning, då det aktiverar synaptotagminproteiner som bidrar till bildandet av SNARE-komplexet och reglerar frisättningens hastighet. Kalciumökningar aktiverar också fosfolipas C (PLC), cPLA2 och kalciumkänsliga adenylatcyklaser som producerar cykliskt AMP (cAMP).
Cykliskt AMP och protein kinas C (PKC)
- PKC: Olika isoformer av PKC i β-celler är antingen känsliga eller oberoende av kalcium och DAG (diacylglycerol). Studier tyder på att konventionella och nya PKC-isoformer inte krävs för glukosinducerad insulinsekretion.
- cAMP: Har en potentiell roll genom att aktivera PKA (protein kinas A) eller EPACs (cAMP-reglerade exchange proteins), men ökning av cAMP vid låga glukosnivåer stimulerar inte insulinsekretion. Nya fynd indikerar att cAMP kan påverka glukosinducerade variationer i insulinfrisättning, även om dess primära roll är osäker.
KATP-kanaloberoende signalvägar
Den förstärkande signalvägen
Utöver den KATP-kanalberoende signaleringen har β-celler en KATP-kanaloberoende “förstärkande” signalväg. Glukos, vid koncentrationer så låga som 1–6 mmol/L, kan fortfarande stimulera insulinfrisättning trots att KATP-kanaler hålls öppna av diazoxid. Denna signalväg kräver glukosmetabolism, men inte aktivering av PKA eller PKC. Studier antyder att denna förstärkande signalväg kan vara nedsatt vid typ 2-diabetes, och utveckling av terapier riktade mot denna mekanism kan återställa β-cellernas funktion.
Aminosyrors påverkan på insulinsekretion
Aminosyror som initiatorer
Flera aminosyror, såsom leucin, lysin och arginin, stimulerar insulinsekretion:
- Leucin: Stimulerar en tvåfasig ökning av insulinfrisättning och aktiverar både KATP-kanalberoende och -oberoende signalvägar. Dess metabolism minskar kaliumpermeabiliteten, depolariserar membranet och öppnar l-typ kalciumkanaler.
- Lysin och arginin: Dessa laddade aminosyror transporteras in i β-celler via ett specifikt system för katjoniska aminosyror. De depolariserar membranet direkt, vilket leder till kalciuminflöde och insulinfrisättning.



