Introduktion #
I en värld där tillgången till föda är intermittent, är förmågan att lagra energi utöver det som krävs för omedelbart bruk avgörande för överlevnad. Fettceller, som finns i olika fettvävnadsdepåer spridda i kroppen, är specialiserade på att effektivt lagra överskottsenergi i form av triglycerider och, vid behov, frigöra lagrad energi som fria fettsyror för användning på andra platser i kroppen. Detta fysiologiska system, som styrs av endokrina och neurala signalvägar, möjliggör för människor att överleva svält i upp till flera månader.
Dock, i en miljö med riklig tillgång till näring och en stillasittande livsstil, samt under påverkan av genetiska faktorer, leder detta system till ökade energilager i fettvävnaden. Detta kan i sin tur ge upphov till negativa hälsoeffekter, inklusive utvecklingen av metabola och kardiovaskulära sjukdomar.
Under de senaste två decennierna har forskningen på ett dramatiskt sätt ökat vår förståelse för de fysiologiska och molekylära mekanismer som reglerar kroppsvikt och kroppsfett. Ett stort framsteg var identifieringen av gener kopplade till fem typer av fetma, så kallade monogena fetmasyndrom.
Dessa fynd ledde till en detaljerad kartläggning av motsvarande genetiska syndrom hos människor. Forskningen har därefter identifierat ytterligare gener som har mindre men ändå betydande effekter på utvecklingen av fetma.
Definition och mätning #
Fetma definieras som ett tillstånd av överskottsmassa i fettvävnad. Även om det ofta ses som synonymt med ökad kroppsvikt, är detta inte alltid fallet, vältränade individer med hög muskelmassa kan ha en hög kroppsvikt enligt numeriska standarder utan att uppvisa ökad fetma.
Kroppsvikter är kontinuerligt fördelade i populationer, vilket gör gränsdragningen mellan “normalviktig” och “fet” något godtycklig. Fetma definieras därför utifrån dess koppling till sjuklighet eller dödlighet.
BMI
Den mest använda metoden för att mäta fetma är Body Mass Index (BMI), som beräknas som kroppsvikt i kilogram delat med kvadraten av kroppslängden i meter (kg/m²). BMI är dock inte en direkt mätning av fettmassa.
Klassifikation enligt WHO
| Klassifikation | BMI (kg/m2) | Hälsorisker |
| Undervikt | < 18,5 | Låga (men andra hälsoproblem uppstår) |
| Normalområde | 18,5-24,9 | Normalrisk |
| Övervikt | 25-29,9 | Lätt ökade |
| Fetma klass I | 30,0-34,9 | Måttligt ökade |
| Fetma klass II | 35,0-39,9 | Höga |
| Fetma klass III | ≥ 40 | Mycket höga |
Andra metoder inkluderar antropometri (hudvecksmätningar), densitometri (undervattensvägning), datortomografi (CT) eller magnetresonanstomografi (MRI), och elektrisk impedans. Enligt data från Metropolitan Life Tables ligger BMI för normalvikt mellan 19 och 26 kg/m² för män och kvinnor med medellängd och medelram. Kvinnor har generellt mer kroppsfett vid samma BMI jämfört med män.
Ett BMI på 30 eller högre används vanligtvis som tröskelvärde för fetma baserat på betydande samband med sjuklighet. För BMI mellan 25 och 30 används termen “övervikt”. Detta intervall bör anses medicinskt signifikant, särskilt i närvaro av riskfaktorer som högt blodtryck eller glukosintolerans.
Fördelningen av fettvävnad i olika anatomiska depåer har också stor betydelse för sjuklighet. Specifikt är intraabdominellt och subkutant bukfett mer problematiskt än subkutant fett på skinkor och lår. Denna fördelning kan kliniskt mätas genom midje-höft-kvoten; ett värde >0,9 för kvinnor och >1,0 för män anses onormalt.
Komplikationer som insulinresistens, diabetes, hypertoni och hyperlipidemi är starkare kopplade till bukfett än till generell fetma. Mekanismerna bakom detta är oklara men kan relatera till att intraabdominella adipocyter är mer lipolytiskt aktiva och frisätter fria fettsyror i portacirkulationen, vilket påverkar levern negativt.
Klassifikation av bukfetma enligt WHO
Risk för metabola komplikationer | Ökad risk | Påtaligt ökad risk |
| Män | ≥ 94 cm | ≥ 102 cm |
| Kvinnor | ≥ 80 cm | ≥ 88 cm |
Fysiologisk reglering av energibalans #
Kroppsvikten regleras genom ett samspel mellan endokrina och neurala komponenter som påverkar energiintag och energiförbrukning. Även små obalanser mellan dessa faktorer kan över tid ge stora förändringar i kroppsvikt. Exempelvis kan en obalans på 0,3 % under 30 år leda till en viktökning på 9 kg. Denna reglering är mycket sofistikerad och kan inte lätt övervakas genom kaloriintag i förhållande till fysisk aktivitet.
Vid viktförlust ökar aptiten och energiförbrukningen minskar, medan vid överätning sjunker aptiten och energiförbrukningen ökar. Dock fungerar inte alltid den senare mekanismen optimalt, vilket möjliggör utveckling av fetma under förhållanden med riklig födotillgång och begränsad fysisk aktivitet.
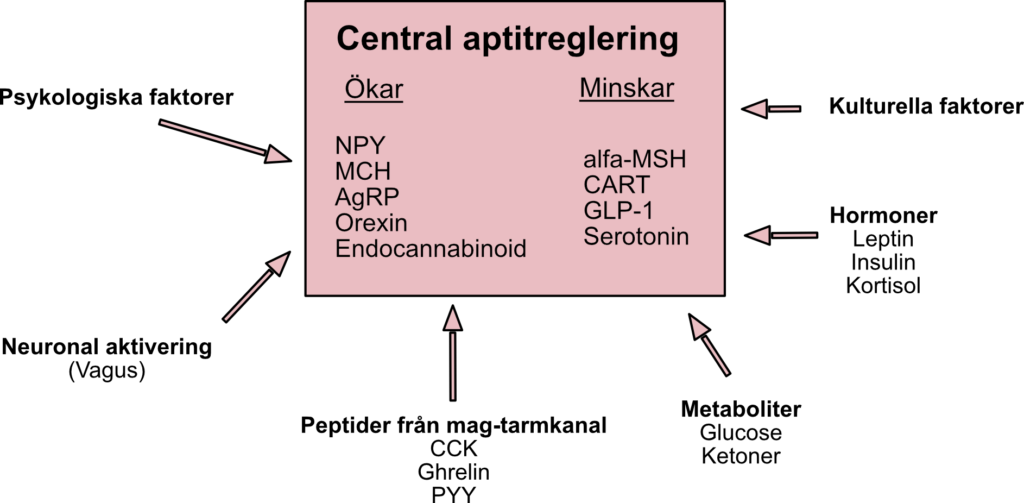
Leptin och hjärnans roll i aptitreglering
Leptin, ett hormon producerat av adipocyter (fettceller), är en central regulator av energibalans. Det verkar främst genom hjärnan, särskilt hypotalamus, för att påverka aptit, energiförbrukning och neuroendokrin funktion.
Hypotalamus tar emot signaler från flera källor:
- Neurala signaler: Vagala impulser från inälvorna, inklusive magsäcksutvidgning.
- Hormonella signaler: Leptin, insulin, kortisol samt tarmhormoner som ghrelin (aptitstimulerande) och PYY (aptitdämpande).
- Metaboliska signaler: Exempelvis glukosnivåer, där hypoglykemi stimulerar hunger.
Dessa signaler påverkar uttryck och frisättning av olika hypotalamiska peptider, inklusive neuropeptid Y (NPY) och agouti-relaterad peptid (AgRP), samt integreras med signalsystem som serotonin, katekolaminer och endocannabinoider.
Energiförbrukningen har fyra huvudkomponenter:
- Basalmetabolism (~70 % av dagligt energibehov)
- Energiåtgång för matspjälkning och lagring av föda
- Termisk effekt av fysisk aktivitet (5–10 % av energiförbrukningen)
- Adaptiv termogenes, som ökar vid långsiktigt ökat kaloriintag.
Basalmetabolismen är den största delen av daglig energiförbrukning och är relativt fast, medan fysisk aktivitet utgör en mindre andel.
Etiologi av fetma #
Fetmans orsaker är fortfarande till stor del okända, även om de molekylära mekanismerna som reglerar energibalansen börjar klarna. Fetma utgör en heterogen grupp av tillstånd, vilket gör det svårt att identifiera en enskild bakomliggande mekanism.
På en basal nivå framstår patofysiologin som enkel: ett kroniskt överskott av näringsintag i förhållande till energiförbrukning. Dock är det neuroendokrina och metabola system som reglerar energiintag, lagring och förbrukning komplexa, vilket gör det utmanande att kvantifiera alla relevanta faktorer över tid hos människor.
Gener och miljö – en komplex interaktion #
Fetma förekommer ofta inom familjer, och ärftligheten för kroppsvikt är jämförbar med den för kroppslängd. Även om genetiska faktorer har en betydande roll, följer inte fetma ett enkelt mendelskt arvsmönster.
Adoptionsstudier har visat att adopterade individer oftare liknar sina biologiska föräldrar än sina adoptivföräldrar när det gäller fetma, vilket starkt stödjer genetiska influenser. Liknande resultat ses hos enäggstvillingar, vars BMI korrelerar starkt oavsett om de vuxit upp tillsammans eller isär, medan tvåäggstvillingar visar svagare samband.
Trots detta förklarar de identifierade genetiska varianterna, både vanliga och sällsynta, mindre än 5 % av variansen i kroppsvikt. Miljön spelar uppenbarligen en avgörande roll, vilket visas av att svältperioder förhindrar fetma även hos individer som är genetiskt benägna att utveckla tillståndet.
Den snabba ökningen av fetmaprevalensen i modern tid kan heller inte förklaras av genetiska förändringar utan beror snarare på miljöfaktorer. Gener verkar dock påverka sårbarheten för fetma i samband med specifika dieter och näringstillgång.
Genetiska faktorer #
Forskning har identifierat olika gener som är associerade med fetma men dessa har en oerhört liten effekt på fetmapandemin
Fetmaepidemin har utvecklats trots att vår genetisk bakgrund inte förändras i samma snabba takt som de yttre faktorerna. Trots detta har forskning tydligt visat att genetiska faktorer spelar en avgörande roll i utvecklingen av övervikt. En vanlig analogi är att “generna laddar vapnet, medan en tillåtande eller giftig miljö avlossar skottet”.
Identifiering av gener
Under de senaste åren har forskningen gjort betydande framsteg i identifieringen av genetiska faktorer som bidrar till övervikt. Dessa gener delas in i två huvudkategorier:
- Sällsynta gener: Gener som direkt orsakar överdrivet kroppsfett, till exempel leptinbrist.
- Vanliga gener: Gener som ökar mottagligheten för att bli överviktig, ofta kallade “känslighetsgener”.
Ett stort steg framåt har tagits genom så kallade genome-wide-association-studies (GWAS). Dessa studier analyserar genetiska variationer hos tiotusentals individer och har hittills identifierat 17 gener kopplade till kroppsvikt. Bland dessa är FTO-genen särskilt framträdande, eftersom den står för hälften av den kända genetiska påverkan. De flesta av dessa gener påverkar aptitregleringen snarare än fettförbränning.
Specifika genmutationer
| Gen | Funktion | Effekt av mutation | Människa | Mus |
| Lep (ob) | Leptin, ett hormon som produceras av fettvävnad | Mutationen förhindrar leptin från att förmedla mättnadssignal; hjärnan uppfattar svält | Ja | Ja |
| LepR (db) | Leptinreceptor | Samma som ovan | Ja | Ja |
| POMC | Proopiomelanokortin, en prekursor för flera hormoner och neuropeptider | Mutationen förhindrar syntes av melanocytstimulerande hormon (MSH), en mättnadssignal | Ja | Ja |
| MC4R | Typ 4-receptor för MSH | Mutationen förhindrar mottagning av mättnadssignal från MSH | Ja | Ja |
| AgRP | Agouti-relaterad peptid, en neuropeptid som uttrycks i hypotalamus | Överuttryck hämmar signalering genom MC4R | Nej | Ja |
| PC-1 | Prohormonkonvertas 1, ett enzym för peptidbearbetning | Mutationen förhindrar syntes av neuropeptid, troligtvis MSH | Ja | Nej |
| FAT | Karboxypeptidas E, ett enzym för peptidbearbetning | Samma som ovan | Nej | Ja |
| Tub | Tub, ett hypotalamiskt protein med okänd funktion | Hypotalamisk dysfunktion | Nej | Ja |
| TrkB | TrkB, en neurotrofinreceptor | Hyperfagi på grund av odefekt hypotalamisk störning | Ja | Ja |
Andra genetiska mutationer kopplade till fetma
Mutationer i flera andra gener är associerade med allvarlig fetma hos människor, även om dessa syndrom är sällsynta:
- Proopiomelanokortin (POMC): Mutationer i POMC-genen orsakar brist på neuropeptiderna α-MSH och β-MSH, som hämmar aptiten via hypotalamus. Detta leder till svår fetma samt sekundär binjurebarksvikt (på grund av ACTH-brist) och karakteristiska drag som blek hud och rött hår.
- Proenzymkonvertas-1 (PC-1): Mutationer i denna gen förhindrar syntesen av α-MSH från dess förstadie POMC, vilket bidrar till hyperfagi och fetma.
- MC4R (Melanocortinreceptor-4): Förlust av funktion i denna receptor, som är central för att hämma aptit i hypotalamus, står för upp till 5 % av fallen med svår fetma.
- MRAP2: Detta protein, nödvändigt för normal MC4R-signalering, har i sällsynta fall visat sig vara defekt hos individer med svår fetma.
Dessa mutationer definierar en neuropeptidstyrd signalväg, där leptin stimulerar POMC och ökar produktionen av α-MSH, vilket begränsar matintag och viktuppgång.
Fetmarelaterade syndrom hos människor
1. Prader-Willis syndrom är ett neurodevelopmentellt tillstånd som kännetecknas av fetma, kortväxthet, mental retardation, hypogonadotrop hypogonadism, muskelhypotoni, små händer och fötter, samt hyperfagi. Syndromet orsakas ofta av minskad uttryck av paternellt ärvda gener i den imprinted regionen 15q11-13. Specifikt kan minskat uttryck av Snord116, en RNA-molekyl som är starkt uttryckt i hypotalamus, bidra till störd hypotalamisk funktion.
2. Bardet-Biedl syndrom (BBS) är en genetiskt heterogen sjukdom som inkluderar fetma, mental retardation, retinitis pigmentosa, diabetes, och flera medfödda missbildningar. Minst 16 genetiska lokus har identifierats, och de flesta av de kodade proteinerna ingår i två multiproteinkomplex som är centrala för ciliefunktion och intracellulär transport. Mutationer kan påverka leptinreceptorns transport i hypotalamiska neuron och orsaka leptinresistens.
Resultat från genetiska studier
Även om framstegen inom genetiska studier har varit betydande, återstår många obesvarade frågor. Hittills har mer än 100 genetiska lokus identifierats som är kopplade till fetma, men dessa förklarar tillsammans mindre än 3 % av variationen i BMI mellan individer. Den mest replikerade regionen omfattar FTO-genen, vars funktion är okänd men som uttrycks i hjärnan. Eftersom ärftligheten för fetma uppskattas till 40–70 % är det sannolikt att många fler gener och gen-miljöinteraktioner återstår att identifiera.
Djurmodeller och ytterligare genetiska kandidater
Studier i gnagare har avslöjat ytterligare molekylära kandidater som kan vara relevanta för mänsklig fetma:
- TUB-genen: Kodar för ett hypotalamiskt protein av okänd funktion; mutationer orsakar fetma med sen debut.
- Fat-genen: Kodar för karboxypeptidas E, ett enzym som är avgörande för neuropeptidproduktion; mutationer leder till fetma genom störd peptidsyntes.
Peptiden AgRP, som är co-exprimerad med NPY i hypotalamus, är en antagonist till α-MSH vid MC4R-receptorer. Dess överuttryck inducerar fetma. Å andra sidan är möss som saknar MCH, en peptid som stimulerar aptit, smala.
Epigenetik och intrauterin prägling
Hur påverkar tidiga förhållanden risken för sjukdom?
Forskning visar att spädbarn som är små för sin ålder vid födseln löper högre risk att utveckla metabola sjukdomar senare i livet. Denna teori, ofta kallad Barker-hypotesen eller “Developmental Origins of Health and Disease”, introducerades av professor David Barker. Idén betonar hur tidiga livsförhållanden, särskilt under fosterstadiet, kan prägla en individs hälsa.
Historiska exempel: Nederländernas hungersnöd
Ett tydligt exempel på intrauterin prägling är hungersnöden i Nederländerna vintern 1944, där invånarna i Amsterdam upplevde allvarlig kaloriunderskott under nazisternas ockupation. Om fostret exponerades för näringsbrist under den första trimestern av graviditeten ökade risken för övervikt senare i livet.
Andra exempel på intrauterin påverkan
- Diabetes hos modern: Barn till mödrar som utvecklade diabetes under graviditeten var tyngre vid födseln jämfört med syskon födda innan modern fick diabetes.
- Rökning under graviditeten: Forskning visar att rökning under graviditeten ökar risken för övervikt hos barnet, särskilt om rökningen fortsatte under hela graviditeten. Även om rökning upphörde efter första trimestern kvarstod en ökad risk.
Dessa exempel visar hur faktorer under fosterstadiet kan påverka kroppsvikt och hälsa långt senare.
Mängden mat och viktuppgång #
Liten daglig kaloriökning kan leda till viktuppgång
Att äta mer energi än vi förbrukar leder till lagring av fett. Den genomsnittliga viktökningen i dagens samhälle är cirka 0,5–1 kg per år. För att gå upp 1 kg krävs ett energiöverskott på cirka 14 000 kcal, vilket motsvarar ungefär 50 kcal per dag – till exempel en liten portion socker.
Detta innebär att en relativt hälsosam livsstil under många decennier resulterar fortfarande i en viktuppgång när man blir äldre.
Har vårt energiintag ökat?
Under de första 80 åren av 1900-talet var det dagliga energiintaget relativt stabilt, men under de senaste 20 åren har det ökat markant:
- Tidigare intag: Cirka 2300 kcal/dag.
- Nyligen: Cirka 2600 kcal/dag, en ökning med 300 kcal/dag.
Denna ökning är mer än tillräcklig för att förklara den genomsnittliga årliga viktuppgången.
Energitäthet och matvanor #
Vad är energitäthet?
Energitäthet beskriver mängden energi (kcal) i förhållande till vikten av en viss matvara (kcal/g). Mat med hög energitäthet innehåller mycket kalorier per gram, medan mat med låg energitäthet innehåller färre kalorier per gram. Energitäthet kan ökas genom att tillsätta fett eller ta bort vatten, och minskas genom att tillsätta vatten eller ta bort fett.
Hur påverkar energitäthet hur mycket vi äter?
Forskning visar att människor tenderar att äta samma vikt av mat, oavsett dess energitäthet. Om maten har hög energitäthet, konsumeras därför fler kalorier. I en studie där deltagarna åt måltider med varierande energitäthet under två dagar, fick de i sig cirka 30 % färre kalorier när måltiderna hade låg energitäthet jämfört med hög.
När både energitäthet och portionsstorlek varierades, visade resultaten att måltider med låg energitäthet och små portioner gav lägst energiintag (398 kcal jämfört med 620 kcal per måltid).
Matvanor och livsstilsfaktorer #
Ammningens påverkan på viktutveckling
Ammning är en tidig matvana som kan påverka risken för övervikt senare i livet. Studier visar att spädbarn som ammas i mer än tre månader har en lägre risk att bli överviktiga i skolåldern och tonåren, jämfört med spädbarn som ammas i mindre än tre månader. Detta kan vara ett exempel på “infantil prägling”, där tidiga matvanor påverkar metabolismen senare i livet.
Äta utanför hemmet: restauranger och snabbmat
Konsumtionen av snabbmat har ökat dramatiskt de senaste decennierna. Att äta snabbmat förändrar också typen av mat som konsumeras. Studier visar att snabbmat ofta ersätter hälsosammare livsmedel som spannmål, mjölk och grönsaker, medan konsumtionen av läsk, pommes frites och sockerrika produkter ökar. Barn som äter snabbmat tenderar att konsumera mer kalorier, fett och tillsatt socker än de som inte gör det.
Nattätarsyndromet
Nattätarsyndromet beskrevs första gången av Stunkard 1955 och har nyligen definierats mer i detalj. Syndromet innebär att en individ äter mer än 50 % av sitt dagliga energiintag under natten. Detta kan vara en form av ohälsosam ätstörning som bidrar till viktökning och andra metabola problem.
Frekvens av måltidsintag
Hur ofta vi äter kan påverka kroppsvikten. Studier visar att män som äter fler måltider per dag tenderar att ha ett lägre BMI (Body Mass Index). I en studie åt män med ett BMI mellan 20 och 25 cirka sex gånger per dag, medan de med ett BMI över 25 åt färre än sex gånger dagligen.
Att äta frukost, som ofta är kopplat till fler måltider under dagen, har också visat sig vara förknippat med lägre kroppsvikt.
Kostens fettinnehåll
Fett är en viktig faktor i fetmaepidemin. Epidemiologiska studier visar att en högre fettandel i kosten är kopplad till en större andel av befolkningen med övervikt. En studie bland sjuksköterskor visade att animaliskt fett, mättat fett och transfett hade en starkare koppling till viktuppgång än fett generellt.
I människor är sambandet mellan fett och övervikt komplext. När vi äter fler kalorier än vi förbrukar lagrar kroppen överskottet som fett. Fett bidrar också till att maten får hög energitäthet, vilket gör det lättare att överkonsumera kalorier.
Vid ett överskott av fett lagras det i fettvävnad, och mängden visceralt fett ökar. Detta kan bidra till inflammation och insulinresistens via frisättning av proinflammatoriska cytokiner, som TNF-α och IL-6, från fettvävnad.
Olika typer av fetter:
- Mättade fetter: ökar LDL-kolesterol, vilket bidrar till hjärt-kärlsjukdom. De lagras också snabbare som fett och kan främja inflammation.
- Fleromättade fetter: har antiinflammatoriska egenskaper och stöder cellmembranens funktion. De främjar hälsosam fettmetabolism genom att aktivera gener kopplade till fettförbränning.
- Transfetter: ökar LDL och minskar HDL, vilket leder till högre risk för fettinlagring och hjärt-kärlsjukdom
Animaliskt fett
Animaliskt fett sägs vara en aning bättre men består fortfarande av mättade-, omättade fettsyror och kolesterol.
Positiva effekter med animaliskt fett
- Omega-3 fettsyror i fisk: Dessa fleromättade fettsyror från animaliskt fett har antiinflammatoriska effekter, förbättrar hjärthälsa och skyddar mot vissa kroniska sjukdomar.
- Nödvändiga funktioner: Animaliskt fett innehåller fettlösliga vitaminer (A, D, E och K) och är en viktig energikälla vid behov.
Låg fysisk aktivitet
Samband mellan stillasittande och övervikt
Låg fysisk aktivitet, exempelvis långvarigt TV-tittande, är kopplat till ökad kroppsvikt. Studier visar att barn och vuxna som ser mer än fem timmar TV per dag har högre risk för övervikt jämfört med de som ser mindre än två timmar.
På biologisk nivå påverkar inaktivitet metabolismen genom att minska muskelaktivitetens behov av energi och försämra insulinkänsligheten, vilket bidrar till ökad fettinlagring, särskilt i visceralt fett. Dessutom påverkas nivåerna av aptitreglerande hormoner som leptin och ghrelin, vilket kan öka hungerkänslan och matintaget.
Fysisk aktivitet och dödlighet
Låg fysisk aktivitet ökar risken för tidig död. Exempelvis fann en studie att inaktiva kvinnor med normal vikt hade 55 % högre risk för dödlighet jämfört med aktiva kvinnor. Överviktiga kvinnor som dessutom var inaktiva hade en mer än dubbelt så hög risk.
Sömn och Vikt
Kortare sömntid är kopplad till ökad risk för övervikt hos både barn och vuxna. Studier visar att barn som sover mindre än 8 timmar per natt löper nästan tre gånger så hög risk för övervikt jämfört med de som sover mer än 11 timmar.
Mönstret är tydligt: ju kortare sömntid, desto högre risk för övervikt. En möjlig förklaring är att sömnbrist påverkar hormoner som reglerar hunger och mättnad, vilket kan leda till ökat energiintag.
Reglering av kroppsfett: homeostatisk energibalans #
Övervikt kan ses som ett problem med kroppens förmåga att svara på feedbacksignaler som reglerar energiintag och -förbrukning. Detta system består av fyra delar:
- Kontrollcenter i hjärnan: Jämförbart med en termostat som tar emot information om kroppens tillstånd via nervsignaler, hormoner och näringsämnen. Hjärnan styr sedan hunger och födosökande beteenden.
- Yttre systemet: Omfattar matsmältningssystemet, lever, muskler, fettvävnad och andra organ som tar emot och bearbetar näring.
- Respons: Hjärnan kan aktivera eller hämma motoriska system och autonoma funktioner för att reglera matintag och energibalans.
- Signalflöde: Informationen om energistatus överförs via nervbanor, hormoner och näringssignaler.
Matsmältning, metabolism och fettlagring #
Energiflödet i kroppen
Det kontrollerade systemet omfattar matsmältningsorganen som bryter ner och absorberar näring, medan lever, muskler och fettvävnad bearbetar och lagrar näringsämnen:
- Fett: Lagrar energi långsiktigt.
- Kolhydrater: Lagras som glykogen i levern (begränsad kapacitet).
- Protein: Lagras i muskler men är inte avsedd för långsiktig energilagring.
Energibalans och viktreglering
För att bibehålla en stabil kroppsvikt måste energiintaget från mat balansera med energiförbrukningen. Fettvävnad har den största lagringskapaciteten för överskottsenergi, medan lagring av kolhydrater och protein är mycket begränsad.
Studier visar att individer med hög förbränning av kolhydrater (hög respiratorisk kvot) är mer benägna att gå upp i vikt, eftersom kroppen måste kompensera genom att öka kolhydratintaget eller minska kolhydratförbränningen.
Utmaningar vid viktnedgång
Personer som har gått ner i vikt har ofta svårt att öka fettförbränningen vid en fettrik diet, vilket kan bidra till att vikten går upp igen. Fysisk aktivitet kan motverka detta genom att underlätta fettförbränning och minska risken för hjärt-kärlsjukdom och typ 2-diabetes.
Brun fettvävnad #
Brun fettvävnad och dess roll
Brun fettvävnad spelar en viktig roll för att reglera kroppstemperatur hos nyfödda genom att omvandla energi till värme istället för att lagra den som ATP (cellens energi). Detta sker via proteinet UCP1 (uncoupling protein-1), som skapar ett läckage av protoner i mitokondrierna och producerar värme.
Upptäckter hos vuxna
Tidigare trodde man att brun fettvävnad hade begränsad betydelse hos vuxna på grund av dess låga nivåer. Ny forskning, med hjälp av avancerade bildtekniker som PET-CT, har dock visat att brun fettvävnad är aktiv hos vuxna och finns i områden som:
- Supraklavikulära regionen (ovanför nyckelbenet).
- Även runt aorta till viss del
- Längs halskotor och bröstkotor.
Påverkan av temperatur och sympatisk stimulering
Brun fettvävnads aktivitet kan påverkas av omgivningstemperatur och det sympatiska nervsystemet. Lägre temperaturer ökar upptaget av glukos, medan högre temperaturer minskar aktiviteten. Det återstår att undersöka om denna aktivitet kan förstärkas genom fortsatt stimulering.
Fettcellen (adipocyter) #
Vad gör fettceller?
Fettceller i fettvävnaden har två huvudsakliga funktioner:
- Lagring och frisättning av fettsyror: Fettceller lagrar fettsyror som kommer från maten eller produceras i levern och fettcellerna själva.
- Endokrina funktioner: Fettceller fungerar som hormonproducerande celler och frisätter molekyler som påverkar ämnesomsättningen och hormonella systemet i kroppen.
Hur mognar fettceller?
Innan fettceller kan utföra dessa funktioner måste de mogna från mesenkymala stamceller till fullt utvecklade fettceller. Denna process sker i två steg:
- Proliferation: Cellerna växer och delar sig efter stimulans från hormoner som insulin och glukokortikoider.
- Differentiering: Cellerna utvecklar egenskaper som gör dem kapabla att lagra fettsyror, bryta ner triglycerider och producera hormoner.
Fettcellens endokrina roll
Upptäckten av hormonet leptin har visat att fettceller inte bara lagrar energi utan också fungerar som en viktig endokrin vävnad. Förutom leptin producerar fettceller andra molekyler som:
- Hormoner och signalämnen som frisätts eller verkar direkt på fettceller: Adiponectin, resistin, TNF-α, IL-6, leptin, PAI-1, angiotensinogen, insulin, glukagon, kortisol, adrenalin, noradrenalin och tillväxthormon.
- Metaboliter: Glycerol, fettsyror och prostacyklin.
Signaler till hjärnan från miljön och kroppen #
Externa och interna signaler
Hjärnan mottar konstant information från omgivningen och kroppen som styr aptiten och födointaget:
- Externa signaler: Syn, ljud och doft identifierar mat på avstånd. Smak och textur ger närmare signaler när maten konsumeras.
- Smakens roll: De klassiska smakerna (sött, surt, bittert, salt och umami) påverkar matval. Till exempel tenderar söta livsmedel, ofta från frukt, att innehålla vitaminer och mineraler, medan bittra smaker kan signalera potentiellt skadliga ämnen.
En sjätte smak, specifik för fetter, har identifierats. Receptorer på tungan känner igen vissa fettsyror, särskilt fleromättade fettsyror. CD36-receptorn, som finns på tungans smaklökar, binder till fettsyror och aktiveras när fetter bryts ner av lingual lipas. Denna aktivering påverkar matsmältningen genom att öka bukspottkörtelns utsöndringar.
Reglering av aptit genom hormonella signaler #
Gastrointestinala peptider
Flera peptider som produceras i mag-tarmkanalen hjälper till att reglera aptiten:
- Minskad aptit: Peptider som kolecystokinin (CCK), gastrinfrisättande peptid, GLP-1 och polypeptid YY minskar matintaget.
- Ökad aptit: Hormonet ghrelin, som produceras i magsäcken, ökar aptiten och minskar energiförbrukningen genom att påverka nervceller i hjärnan.
Genetiska och peptidbaserade mekanismer i matintag och viktreglering
Melanocortinreceptorer och genetiska förändringar
Melanocortin-4-receptorn (MC4R) spelar en viktig roll i aptitreglering och kroppsvikt. Studier visar att genetiska mutationer i MC4R-genen är associerade med betydande övervikt. Mutationerna kan förekomma i både kodande regioner och reglerande komponenter av genen.
- Effekter av mutationer: Vissa mutationer påverkar aptit och matintag kraftigt, medan andra har liten eller ingen effekt.
- Experiment på möss: Möss som saknar dessa receptorer blir extremt överviktiga, vilket understryker receptorernas betydelse.
Hormoner som ökar aptiten #
Ghrelin
- Ursprung: Magsäcken (fundus).
- Känd som “hungershormonet,” ghrelin stimulerar aptiten genom att påverka hypotalamus. Nivåerna ökar före måltider och minskar efter att man ätit.
Neuropeptid Y (NPY)
- Ursprung: Hypotalamus.
- En kraftfull stimulator av matintag, särskilt med sug efter kolhydrater. Frisätts vid energibrist.
Agouti-Relaterad Peptid (AGRP)
- Ursprung: Arcuate nucleus i hypotalamus.
- Hämmar aptitdämpande signaler och ökar hungern. Arbetar motsatt till α-MSH (melanocytstimulerande hormon).
Orexin (Hypokretin)
- Ursprung: Laterala hypotalamus.
- Ökar matintaget och är även involverad i reglering av sömn och vakenhet.
Endocannabinoider
- Ursprung: Hjärnan (CB1-receptorer) och perifera vävnader.
- Förstärker aptiten, särskilt för kaloritäta och fettrika livsmedel, genom att interagera med det endocannabinoida systemet.
Hormoner som minskar aptiten #
Leptin
- Ursprung: Fettvävnad (fettceller).
- Signalerar till hypotalamus för att dämpa aptiten och öka energiförbrukningen. Höga nivåer är associerade med mättnad, men leptinresistens kan uppstå vid fetma.
Glukagonliknande Peptid-1 (GLP-1)
- Ursprung: L-celler i tunntarmen.
- Minskar aptiten genom att bromsa magsäckstömningen och främja känslan av mättnad.
Peptid YY (PYY)
- Ursprung: L-celler i distala tunntarmen och tjocktarmen.
- Frisätts efter måltider och hämmar aptiten genom att påverka hypotalamus och minska tarmrörelser.
Kolecystokinin (CCK)
- Ursprung: Tunntarmen.
- Dämpar aptiten genom att främja mättnadskänsla och bromsa magsäckstömningen.
Insulin
- Ursprung: Betaceller i bukspottkörteln.
- Minskar aptiten indirekt genom att signalera till hjärnan om energitillgång. Höga insulinnivåer efter måltid är kopplade till mättnad.
Amylin
- Ursprung: Betaceller i bukspottkörteln.
- Arbetar tillsammans med insulin för att dämpa aptiten och bromsa magsäckstömningen.
Oxyntomodulin
- Ursprung: L-celler i tarmen.
- Minskar hunger och ökar energiförbrukningen.
α-Melanocytstimulerande Hormon (α-MSH)
- Ursprung: Arcuate nucleus i hypotalamus.
- Hämmar aptiten genom att påverka melanocortinreceptorer i hypotalamus.
Bukspottkörtelns peptider #
Bukspottkörteln producerar peptider som påverkar födointaget:
- Amylin: Ett hormon som minskar matintaget genom att påverka receptorer i hjärnstammen och hypotalamus.
- Insulin: produceras av beta-celler och minskar blodsockernivåer genom upptag av glukos i celler, stimulerar glykogensyntes och hämmar lipolys samt glukosproduktion i levern
- Ghrelin: Ghrelin är ett peptidhormon som huvudsakligen reglerar aptit och energibalans. Det är mest känt som “hungershormonet” eftersom det stimulerar hunger och matintag genom att agera på hjärnan. Genom aptitregleringen, stimulering av tillväxthormonfrisättning, ökad rörlighet i mag-tarmkanalen och stimulerar produktion av magsyra, vilket underlättar matsmältningen. Ghrelin frisätts huvudsakligen från magsäcken (corpus fundus) och produceras även i tunntarmen och bukspottkörteln, hypotalamus i hjärnan.
- Pankreatisk polypeptid: produceras av pp-celler
- Somatostatin: produceras i delta-celler och minskar frisättning av mag-tarmhormoner som gastrin och sekretin, hämmar även magtömning och utsöndring av matsmältningsenzymer.
- Glukagon: produceras av alfa-celler och höjer blodsockernivåer genom att stimulera glukosfrisättning från levern via nedbrytning av glykogen samt stimulerar fettnedbrytning i fettvävnaden.
Hjärnan och matintag #
Hjärnans centrala roll i aptitreglering
Hjärnan fungerar som en central mottagare, omvandlare och sändare av information från kroppens perifera organ. Genom att använda sensoriska organ och interna signaler bearbetas informationen via neurotransmittorer i hjärnan, vilket i sin tur aktiverar nervbanor, hormoner och motoriska system.
Höger prefrontala cortex (PFC):
- Viktig för kognitiva processer kopplade till matintag och fysisk aktivitet.
- Skador på höger frontallob kan orsaka förändrat matbeteende, som t.ex. “gourmand syndrome,” ett tillstånd där individer utvecklar en stark passion för mat, särskilt fin mat.
Monoaminer och aptitreglering
Monoaminer, som noradrenalin, serotonin, dopamin och histamin, spelar viktiga roller i att reglera matintag:
- Serotonin: Minskar fettintaget genom 5-HT2C-receptorer. Stimulering av dessa receptorer påverkar fettintaget utan att påverka konsumtionen av protein eller kolhydrater.
- Noradrenalin: α1-receptorer minskar aptiten, medan α2-receptorer kan öka den.
- Opioider: Mu-opioidreceptorer stimulerar fettintag, medan kortikotropinfrisättande hormon (CRH) minskar aptiten.
Endocannabinoidsystemet
Det endocannabinoida systemet, med CB1-receptorn, är en central aktör i aptitreglering:
- Stimulering av CB1-receptorn: Ökar matintaget.
- Antagonister mot CB1: Har visat sig minska aptiten och leda till viktminskning.
Leptin och kontroll av energibalans #
Leptinets roll
Leptin är ett hormon som produceras i fettvävnad och spelar en avgörande roll i att reglera kroppsvikt och energibalans:
- Transport: Leptin når hjärnan via blod–hjärnbarriären och verkar på leptinreceptorer i arcuate nucleus.
- Effekter: Leptin minskar produktionen av aptitstimulerande neuropeptid Y (NPY) och agouti-relaterad peptid (AGRP) samtidigt som det ökar produktionen av aptithämmande peptider som pro-opiomelanocortin (POMC) och α-MSH.
NPY och AGRP
- NPY: En av de mest kraftfulla stimulatorerna av matintag, även om dess frånvaro inte alltid påverkar kroppsvikten.
- AGRP: Blockerar α-MSH:s aptithämmande effekt, vilket kan leda till överätande.
POMC och α-MSH
POMC är en föregångare till α-MSH, som verkar på melanocortinreceptorer i hypotalamus för att minska aptiten. Mutationer i dessa receptorer är kopplade till övervikt.
Andra mekanismer och receptorer #
Histamin
Histaminreceptorer, särskilt H1, reglerar matintag genom att minska aptiten vid stimulering. Blockering av H3-receptorn, som kontrollerar frisättningen av histamin, kan också minska matintaget.
Dopamin
Dopamin påverkar säsongsbetonat födointag hos djur, som förbereder sig för migration eller dvala. Mutationer i D2-receptorgen är kopplade till övervikt hos människor, och dopaminantagonister kan inducera viktuppgång.
Peptider i hypotalamus och matintag #
CART och Melanin-Koncentrerande Hormon (MCH)
- CART (Cocaine- and Amphetamine-Regulated Transcript):
- Co-lokaliserad med POMC och hämmar matintag.
- Potentiella behandlingar kan innefatta läkemedel som förhindrar nedbrytning av dessa peptider.
- MCH:
- Produceras nästan uteslutande i laterala hypotalamus.
- Effekt: Ökar matintaget när det injiceras i hjärnan.
- Djurstudier: Överuttryck av MCH leder till viktökning, medan avsaknad av peptiden gör djuren magra.
Orexin A och RFa-Peptider
- Orexin A (Hypokretin):
- Påverkar både matintag och sömn.
- Har en mindre uttalad effekt på aptit jämfört med andra peptider.
- RFa-Peptider (Arginin-Fenylalanin-Amider):
- Har en evolutionärt bevarad struktur och stimulerar matintag i däggdjur.
- Fem gener och receptorer har identifierats hos människor, men deras roll i mänsklig metabolism är fortfarande oklar.
Nerver och hormonell kontroll av metabolism #
Hormoner och fettfördelning
Endokrina och autonoma nervsystemet styr viktiga processer för energibalans och fettfördelning. Viktiga hormoner inkluderar:
- Tillväxthormon och sköldkörtelhormon:
- Främjar kroppens tillväxt och energiförbrukning.
- Studier på möss med överuttryckt tillväxthormon visar ökad aptit, insulinresistens och viktökning.
- Testosteron och Östrogen:
- Testosteron: Ökar muskelmassa och minskar visceralt fett. Minskade nivåer hos äldre män är associerade med ökad fettmassa och minskad muskelmassa.
- Östrogen: Ökar fettlagring, särskilt efter menopaus, vilket kan bidra till mer visceralt fett.
Kortisol och Visceralt Fett
Enzymet 11-β-hydroxysteroid dehydrogenas typ 1 konverterar kortison till kortisol och är viktigt för fettlagring:
- Höga nivåer av kortisol i visceralt fett: Skapar förutsättningar för ny fettcellsbildning.
- Efter menopaus: Förändringar i enzymaktiviteten kan öka risken för ansamling av visceralt fett hos kvinnor.
Det sympatiska nervsystemet och fetma
Roll i fettreglering
Det sympatiska nervsystemet kopplar hjärnan till perifer metabolism och reglerar fettnivåer:
- Studier på möss: Möss utan β1-, β2- och β3-receptorer utvecklar fetma, kallintolerans och höga nivåer av fria fettsyror i blodet.
- Funktion: Det sympatiska nervsystemet är avgörande för att motverka fetma och bibehålla termoreglering.



