SGLT2‑hämmare vid hjärtsvikt: Empagliflozin (Jardiance) och Dapagliflozin (Forxiga)
Introduktion till hjärtsvikt
Hjärtsvikt är ett kliniskt syndrom som innebär att hjärtats pumpfunktion är otillräcklig för att tillgodose kroppens metabola behov, eller där detta endast kan uppnås till priset av förhöjda fyllnadstryck i hjärtat. Hjärtsvikt är dessvärre relativt vanligt, särskilt bland personer med diabetes, och progressivt med betydande morbiditet och mortalitet.
Baserat på hjärtats systoliska och diastoliska funktion klassificeras hjärtsvikt i tre kategorier (Tabell 1). Dessa kategorier utgör fenotyper med varierande etiologi och behandling. De benämns hjärtsvikt med reducerad ejektionsfraktion (HFrEF), hjärtsvikt med måttligt nedsatt ejektionsfraktion (HFmrEF) samt hjärtsvikt med bevarad ejektionsfraktion (HFpEF).
Nedan följer en översikt av klassificering och diagnostik av hjärtsvikt, samt SGLT2-hämmarnas roll i behandling av hjärtsvikt.
Tabell 1: Klassificering av hjärtsvikt
| Typ av hjärtsvikt | HFrEF | HFmREF | HFpEF |
| 1 | Symptom +/- objektiva fynd | Symptom +/- objektiva fynd | Symptom +/- objektiva fynd |
| 2 | LVEF ≤ 40% | LVEF 41-49% | LVEF ≥ 50% |
| 3 | Indikationer på strukturella eller funktionella avvikelser, såsom diastolisk dysfunktion, förhöjda fyllnadstryck och förhöjda nivåer av natriuretiska peptider. |
Hjärtsvikt med reducerad (nedsatt) ejektionsfraktion förkortas HFrEF och definieras som hjärtsvikt med ejektionsfraktion ≤40%. Ejektionsfraktion mellan 41%–49% defineras som måttligt reducerad (HFmrEF). Hjärtsvikt med bevarad ejektionsfraktion (HFpEF) definineras som hjärtsvikt med normal ejektionsfraktion, vilket definineras som ≥50%. HFpEF orsakas primärt av diastolisk dysfunktion, som leder till stegrade fyllnadstryck i kammare och förmak. Som regel finns strukturella förändringar och objektiva bevis på nedsatt diastolisk funktion; exempel på sådana förändringar är vänsterkammarhypertrofi, dilatation av vänster kammare, dokumentation av förhöjda fyllnadstryck, osv. HFpEF är ett komplext tillstånd och är särskilt vanligt bland personer med diabetes och metabola syndromet.
Samsjuklighet vid hjärtsvikt
Hjärtsvikt med reducerad ejektionsfraktion (HFrEF) är vanligen associerad med ischemisk hjärtsjukdom, hypertoni och diabetes mellitus. Hjärtsvikt med bevarad ejektionsfraktion (HFpEF) utgör ett mer heterogent syndrom som ses vid obesitas, diabetes, hypertoni, förmaksflimmer, kronisk lungsjukdom, och är dessutom överrepresenterat hos kvinnor.
Vänsterkammarfunktion
Ekokardiografisk bedömning
Ekokardiografi är den vanligaste bilddiagnostiska metoden för att undersöka olika parametrar för hjärtfunktionen. Undersökningen genomförs vanligtvis av kardiologer, kliniska fysiologer och biomedicinska analytiker som bedömer ejektionsfraktion och andra parametrar.
Ejektionsfraktion (EF) är den procentsats blod som vänster kammare pumpar ut med varje kontraktion.
Många faktorer kan påverka ejektionsfraktionen, inklusive preload, afterload och kontraktilitet. En normal EF ligger mellan 55-69 % och beräknas med följande ekvation:
EF (%) = slagvolym (SV) / slutdiastolisk volym (EDV)
Ekokardiografiska markörer för bedömning av VK‑funktion:
- Fraktionell förkortning – Mäter den procentuella minskningen av vänsterkammarens diameter under systole och indikerar kontraktionsförmåga
- Ejektionsfraktion – Procentandel av blod som pumpas ut från vänsterkammaren vid varje sammandragning, en nyckelmarkör för pumpfunktion
- Slagvolym – Mängden blod som pumpas ut per hjärtslag, beräknat som skillnaden mellan slutdiastoliskt och slutsystoliskt volym
- Hjärtminutvolym – Total mängd blod som pumpas av hjärtat per minut, beräknat som slagvolym multiplicerat med hjärtfrekvens
- Tei-index – Ett mått som kombinerar systolisk och diastolisk funktion genom att relatera isovolumetriska tider till ejektionstid
- Kontraktilitet (dp/dt) – Mäter tryckstegringshastigheten i vänsterkammaren under systole och reflekterar muskelns kontraktionsstyrka
Normalvärden för slagvolym och hjärtminutvolym
| Parameter | Friska män | Friska kvinnor |
| Slagvolym (mL) | 70–100 mL | 60–85 mL |
| Hjärtminutvolym (L/min) | 4.0–8.0 L/min | 3.5–7.5 L/min |
Epidemiologi
I Sverige uppskattas prevalensen av hjärtsvikt till ~2 % i befolkningen och >10 % hos personer över 80 år. Hjärtsvikt är den vanligaste orsaken till sjukhusinläggning bland patienter ≥65 år. Det är en global hälsoutmaning som drabbar cirka 64 miljoner människor världen över. Följaktligen lever ungefär 200000 svenskar med diabetes. Hjärtsvikt med nedsatt ejektionsfraktion (HFrEF) är vanligare bland män och yngre individer, medan hjärtsvikt med bevarad ejektionsfraktion (HFpEF) utgör ungefär hälften av alla fall och har ökat kraftigt de senaste decennierna, särskilt bland äldre och kvinnor.
Ökningen av HFpEF sammanfaller med en åldrande befolkning och en ökning av kardiovaskulära riskfaktorer. De främsta riskfaktorerna för hjärtsvikt inkluderar ålder, hypertoni, diabetes, övervikt, obesitas och ischemisk hjärtsjukdom. Dessa faktorer bidrar till både utveckling och progression av sjukdomen, oavsett typ av hjärtsvikt.
Behandling vid hjärtsvikt
Terapeutiska huvudprinciper
- Neurohormonell blockad
- ACE: Enalapril, Ramipril, Lisinopril, Captopril
- ARB: Losartan, Candesartan, Valsartan
- ARNI: Entresto (Sacubitril/valsartan)
- Entresto är det enda godkända preparatet i denna grupp.
- Betablockerare: Bisoprolol, Metoprolol, Carvedilol
- MRA: Eplerenon, Spironolakton
2. Vätskedrivande:
- Furix som ges för symtomlindring och vätskekontroll.
3. Tilläggsstrategier:
- Järninfusion, CRT/ICD, mitral‑/trikuspidintervention, LVAD eller transplantation vid avancerad svikt.
4. Glukometabol behandling:
- Antihyperglykemiska preparat vid typ 2 diabetes, såsom metformin, sulfonylureaderivat (SU‑preparat) och akarbos, samt moderna inkretinbaserade terapier med GLP‑1‑analoger, däribland semaglutid och tirzepatid.
5. Icke‑farmakologiskt:
- Salt‑ och vätskebalans, fysisk träning, patientutbildning och uppföljning via hjärtsviktsmottagning.
6. SGLT2‑hämmare:
- SGLT2-hämmare är förstahandsbehandling vid både HFrEF och HFpEF.
SGLT2-hämmare
SGLT2‑hämmare är en läkemedelsklass som selektivt inhiberar natrium‑glukos‑kotransportör 2 i njurarnas proximala tubuli. Blockeringen medför glukosuri och natriures, vilket leder till lägre blodglukos, minskad plasmavolym och sänkt intraglomerulärt tryck.
Randomiserade studier: kardiovaskulära fördelar
SGLT2-hämmare, ursprungligen utvecklade för behandling av typ 2 diabetes, har i randomiserade kontrollerade studier (RCT) visat signifikanta kardiovaskulära fördelar. Särskilt framträdande är dessa läkemedels effekt avseende att miska risken för hospitalisering på grund av hjärtsvikt samt kardiovaskulär död hos patienter med både nedsatt och bevarad ejektionsfraktion.
Effekt oberoende av diabetesstatus
Detta gäller både personer med och utan diabetes. Effekten av SGLT2-hämmare är således oberoende av diabetesstatus och glykemisk kontroll, vilket indikerar att den skyddande effekten inte är en funktion av effekte på blodsocker. Dessutom uppkommer den skyddande effekten snabbt efter behandlingsstart, vilket också indikerar att effekten inte medieras av blodsockerkontroll.
Begränsningar: ingen minskning av hjärtinfarkt
Kliniska prövningar har dock inte visat en signifikant minskning av risken för fatal eller icke-fatal hjärtinfarkt (MI), och inte heller risken för hospitalisering på grund av hjärtsvikt efter en hjärtinfarkt.
Mekanismer bakom hjärtsviktsreduktion
De snabba kardiovaskulära effekterna hos SGLT2-hämmare tyder på att dessa läkemedel kan reducera hjärtsviktsrisk post-hjärtinfarkt genom att förbättra hjärtfunktionen via flera mekanismer. Dessa inkluderar volymreduktion via osmotisk diures orsakad av glukosuri och natriures, sänkt systoliskt blodtryck, samt förbättrad metabolism i myokardiet.
En potentiell förklaring till den gynnsamma effekten på myokardfunktion är ett skifte från glukosoxidation till ketonkroppsförbränning.
Potentiella långsiktiga metabola effekter
Ytterligare faktorer som reducerad inflammation, minskad oxidativ stress, minskade glykerade slutprodukter (AGE) och reduktion av epikardiellt och visceralt fett kan vara bidragande faktorer, men dessa förändringar uppkommer långsamt och förklarar sannolikt inte den snabba minskningen av risk för hospitalisering för hjärtsvikt.
I Sverige är för närvarande två SGLT2‑hämmare godkända för klinisk användning:
Mekanistiska och metabola aspekter
- Diuretisk och hemodynamisk effekt: Den milda natriuresen och osmotiska diuresen leder till reducerad blodvolym och sänkt fyllnadstryck. Detta avlastar hjärtat (minskar preload) och kan sänka blodtrycket något. I DELIVER sågs t.ex. en genomsnittlig systolisk BT-sänkning på ~1,8 mmHg med dapagliflozin jämfört med placebo. Minskad volym minskar stasen i lung- och systemkretslopp, vilket förbättrar symtom och minskar risken för dekompensation. Noterbart är dock att SGLT2-hämmare inte är lika kraftfulla diuretika som loopdiuretika; de triggar ett måttligt natriures-diures men med bevarad elektrolytbalans. Mekanismen tros också minska interstitiell vätskeretention selektivt (möjligen via effekt på lymfflöde), vilket kan förklara förbättring av hjärtsviktssymtom utan uttorkning.
- Renala effekter: Genom att hämma glukos- och natriumupptag i proximala tubuli reduceras också tubuloglomerulär feedback-dysregulationen. Hos diabetiker och hjärtsviktspatienter är ofta intraglomerulärt tryck förhöjt; SGLT2-hämning leder till ökad natriumleverans till macula densa vilket konstrigerar afferenta arteriolen och sänker filtrationstrycket. Resultatet blir en initial liten GFR-reduktion men bättre bevarad njurfunktion på lång sikt. Både empagliflozin och dapagliflozin har i kliniska prövningar visat tydlig njurprotektiv effekt – de minskar progression till terminal njursvikt och albuminuri. Den förbättrade njurfunktionen bryter den onda cirkeln mellan hjärta och njure (cardiorenal syndromet), vilket sannolikt bidrar till färre hjärtsviktsförsämringar över tid. En annan intressant observation är att SGLT2-hämmare kan påverka kaliumhomeostasen gynnsamt: i EMPEROR-studierna minskade empagliflozin risken för hyperkalemi trots utbredd RAAS-blockad, vilket kan underlätta optimal HF-behandling med MRA även hos njursjuka patienter.
- Metabola effekter – ketoner och substrat: SGLT2-hämning inducerar ett energiskifte. Genom glukosuri förlorar kroppen kalorier, vilket driver en ökad lipolys och leverproduktion av ketonkroppar (beta-hydroxibutyrat m.fl.). Plasmanivåerna av ketoner stiger påtagligt under behandling, även vid normoglykemi. Ketonkroppar utgör ett effektivt bränsle för hjärtmuskeln – de metaboliseras med högre energieffektivitet per syremolekyl än glukos eller fett. En hypotes är att SGLT2-hämmare förbättrar hjärtmuskelns energiutnyttjande genom att tillhandahålla mer ketoner (“superfuel”) och reducera hjärtats beroende av fettoxidation. Hos patienter med hjärtsvikt, där energimetabolismen är rubbad och myokardiet energisvultet, kan detta metabola skifte förbättra kontraktilitet och effektivitet. Studier har också noterat ökad fettoxidation och minskad anaerob glykolys i myokardiet under SGLT2-hämning, vilket kan minska laktatbildning och förbättra arbetsförmågan.
- Hjärtmorfologi och remodellering: Prekliniska data tyder på att SGLT2-hämmare kan hämma hjärt-cellulära Na+/H+-utbytaren (NHE) i kardiomyocyter, vilket leder till lägre intracellulärt Na^+ och Ca^2+. Detta kan minska hypertrofi och diastolisk dysfunktion. Djurstudier och små studier på människor antyder minskad myokardiell fibros och förbättrad diastolisk relaxation under behandling. I en eko-substudie av EMPA-TROPISM (hjärtsvikt utan diabetes) sågs förbättrad EF och minskade kammarvolymer med empagliflozin, vilket talar för reverse remodeling. Dapagliflozin och empagliflozin har också visats reducera pro-inflammatoriska markörer (möjligen genom att hämma NLRP3-inflammasomen) och oxidativ stress i experimentella modeller. Sammantaget verkar SGLT2-hämning ha multifaktoriella hjärtskyddande effekter: minskad väggstress, antifibrotisk verkan och förbättrad cellulär metabolism.
- Vikt, blodtryck och andra metabola parametrar: Som nämnt leder behandlingen till måttlig viktminskning genom kaloriförlust (i DAPA-HF var skillnaden i kroppsvikt ca –0,7 till –2,5 kg beroende på utgångs-BMI). Detta kan förbättra hälsoparametrar såsom blodtryck och insulinresistens. SGLT2-hämmare förbättrar dessutom glykemisk kontroll hos diabetiker utan risk för hypoglykemi i sig. De sänker även urinsyrahalten i blodet (via ökad utsöndring), vilket potentiellt minskar giktbesvär. Mindre studier har föreslagit att de kan minska mängden epikardiellt fett och leversteatos, vilket kan vara positivt för kardiometabolisk hälsa.
Ur biokemisk synvinkel är empagliflozin och dapagliflozin mycket lika. Bägge är potenta och selektiva SGLT2-hämmare (empagliflozin något mer selektiv för SGLT2 över SGLT1 än dapagliflozin, men bägge har minimal SGLT1-inhibition i terapeutiska doser).
Farmakokinetiskt tas läkemedlen en gång dagligen och har halveringstid på 12–15 timmar. Dapagliflozin metaboliseras främst hepatisk (via UGT1A9) medan empagliflozin delvis utsöndras oförändrat via njurarna, men dessa skillnader påverkar inte klinisk användning nämnvärt.
Inga studier tyder på någon relevant skillnad i hur de påverkar exempelvis ketonproduktion eller diures – deras kliniska effekter och påverkan på biologiska markörer överlappar till stor del. Att empagliflozin först visade kardiovaskulär dödlighetsreduktion i EMPA-REG (diabetesstudien) ledde till spekulationer om unika egenskaper, men senare visade dapagliflozin i DAPA-HF liknande fördelar. Idag betraktas SGLT2-hämmarnas hjärtsviktsnytta som en klasseffekt baserad på deras gemensamma mekanismer.
I kontrast till andra hjärtsviktsläkemedel verkar SGLT2-hämmare inte via neurohormonell blockad eller ökning av natriuretiska peptider.
Kostnad för SGLT2-hämmare
| Läkemedel | AUP‑pris per tablett | Bruttokostnad/år (utan förmån) | Patientandel/år med högkostnadsskydd (2025) | Subvention/år (stat & region) |
| Jardiance | 14,11 kr | ≈ 5 150 kr | ≈ 2 700 kr | ≈ 2 450 kr |
| Forxiga | 14,12 kr | ≈ 5 154 kr | ≈ 2 704 kr | ≈ 2 450 kr |
Empagliflozin (Jardiance)
De kliniska prövningar som har utvärderat effekten av empagliflozin (Jardiance) vid hjärtsvikt omfattar EMPEROR‑Reduced, EMPEROR‑Preserved, EMPA‑REG och EMPULSE.
EMPEROR-Reduced
EMPEROR-Reduced (2020) påvisade att empagliflozin ger liknande gynnsamma effekter vid HFrEF. I denna RCT inkluderades 3 730 patienter med kronisk HFrEF (LVEF ≤40%, ~50% med diabetes) och randomiserades till empagliflozin 10 mg dagligen eller placebo.
Det primära utfallet (kardiovaskulär död eller sjukhusinläggning för försämrad hjärtsvikt) inträffade hos 19,4% med empagliflozin vs 24,7% med placebo, vilket innebär en 25% relativ riskreduktion– praktiskt taget identisk med DAPA-HF:s resultat och statistiskt signifikant (p<0,001).
Även här drevs effekten främst av färre hjärtsviktsinläggningar (31% lägre risk). Empagliflozin tenderade även att minska kardiovaskulär död (~8% relativ riskreduktion), men detta enskilda utfall nådde inte statistisk signifikans (HR 0,92; 95% KI 0,75–1,12).
Viktigt är att nyttan av empagliflozin sågs över hela bredden av bakgrundsbehandling (inklusive hos ~20% som stod på ARNI) och oberoende av om patienten hade diabetes eller. Båda studierna (DAPA-HF och EMPEROR-Reduced) bekräftar således klass-effekten: SGLT2-hämmare reducerar risken för sjukhusinläggning och död vid HFrEF med cirka 20–25%.
Dessa resultat har varit praxisförändrande; riktlinjer har infört SGLT2-hämmare som en fjärde hörnsten i HFrEF-behandling (utöver RAS-blockad, betablockad och MRA) för att förbättra överlevnad och minska sjukhusinläggningar.
Tabell som sammanfattar EMPEROR-Reduced
| Kategori | Beskrivning |
|---|---|
| Inklusionskriterier | – Vuxna med HFrEF (LVEF ≤40%) och NYHA-klass II-IV. – Höjda NT-proBNP-nivåer (≥600 pg/ml vid sinusrytm, ≥1200 pg/ml vid förmaksflimmer). – Stabil hjärtsvikt ≥3 månader. – Standardbehandling (t.ex. ACE-hämmare, betablockerare, MRA). |
| Primärt utfall | Tid till kardiovaskulär död eller förvärrad hjärtsvikt (som kräver intravenös behandling eller sjukhusvård). |
| Sekundära utfall | – Första och upprepade hjärtsviktssjukhusvårdningar. – Hastighet av eGFR-försämring. – Klinisk förbättring (KCCQ-poäng). |
| Medelålder | ~67 år |
| HbA1c | ~6.2% (endast ~50% av deltagarna hade diabetes). |
| Komorbiditeter | – Diabetes: 50%. – Högt blodtryck: 71%. – Kronisk njursjukdom (eGFR <60 ml/min/1.73 m²): 54%. – Tidigare hjärtinfarkt: 48%. |
| Resultat | – 25% minskning av primärt utfall (HR 0.75, 95% CI 0.65–0.86). – 30% minskning av hjärtsviktssjukhusvårdningar. – 50% lägre försämring av njurfunktion (eGFR). |
| Säkerhet | Vanligaste biverkningar: hypotoni (10%), urinvägsinfektion (9%). |
Effekt på det primära utfallsmåttet
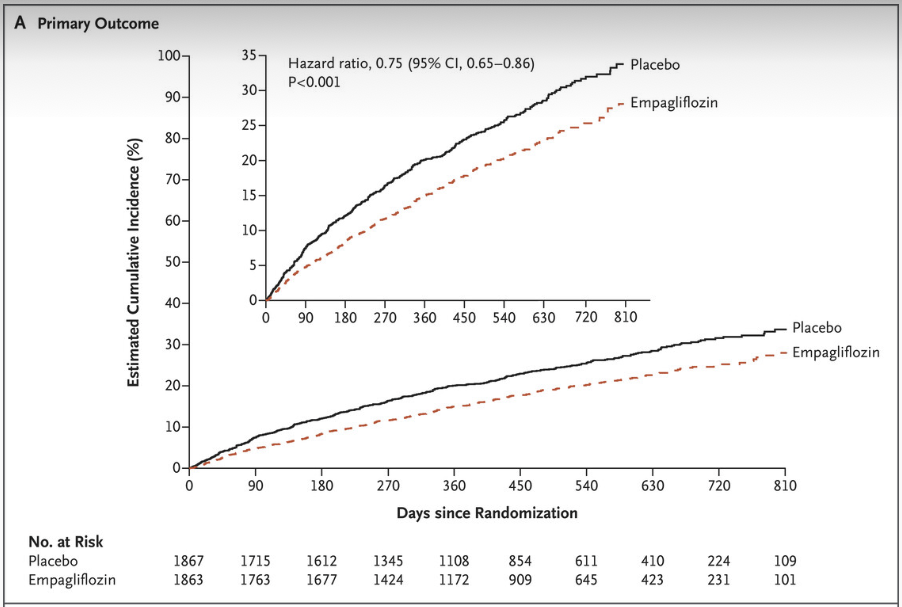
Figuren ovan visar att tiden till kardiovaskulär död eller förvärrad hjärtsvikt – definierad som behov av intravenös behandling eller sjukhusinläggning – var 25 procent mindre hos patienter som behandlades med empagliflozin (Jardiance) än hos dem som erhöll placebo.
Effekt på det sekundära utfallsmåttet
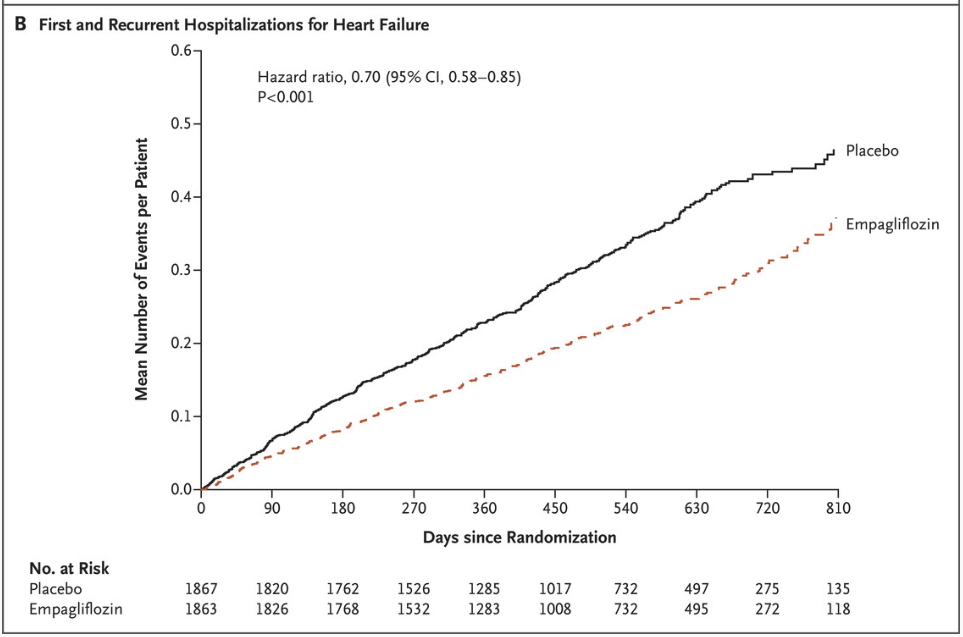
För förstagångs- och återinläggningar på sjukhus för hjärtsvikt noterade man en 30% riskminskning jämfört med placebo.
Relativa riskmått för primär utfallsvariabel
| Utfall | Empagliflozin-grupp Antal (%) | Incidens per 100 patientår | Placebogrupp Antal (%) | Incidens per 100 patientår | Hazardkvot (HR) 95% KI | p-värde |
|---|---|---|---|---|---|---|
| Primärt sammansatt utfall | 361 (19,4%) | 15,8 | 462 (24,7%) | 21,0 | 0,75 (0,65–0,86) | <0,001 |
| Inläggning för hjärtsvikt | 246 (13,2%) | 10,7 | 342 (18,3%) | 15,5 | 0,69 (0,59–0,81) | – |
| Kardiovaskulär död | 187 (10,0%) | 7,6 | 202 (10,8%) | 8,1 | 0,92 (0,75–1,12) | – |
EMPEROR-Preserved
En tabell som sammanfattar EMPEROR-Preserved-studien
| Kategori | Beskrivning |
|---|---|
| Inklusionskriterier | – Vuxna med HFpEF (LVEF >40%) och NYHA-klass II-IV. – Höjda NT-proBNP-nivåer (≥300 pg/ml vid sinusrytm, ≥900 pg/ml vid förmaksflimmer). – Stabil hjärtsvikt ≥3 månader. – Tillåten standardbehandling (t.ex. diuretika, ACE-hämmare). |
| Primärt utfall | Tid till kardiovaskulär död eller förvärrad hjärtsvikt (krävande intravenös behandling eller sjukhusvård). |
| Sekundära utfall | – Första och upprepade hjärtsviktssjukhusvårdningar. – Förändring i eGFR (njurfunktion). – Förbättring av livskvalitet (KCCQ-poäng). – Sammansatt njurutfall (≥40% eGFR-minskning, dialys/död). |
| Medelålder | ~72 år |
| HbA1c | ~6,0% (cirka 49% av deltagarna hade diabetes). |
| Komorbiditeter | – Diabetes: 49%. – Högt blodtryck: 88%. – Kronisk njursjukdom (eGFR <60 ml/min/1.73 m²): 50%. – Förmaksflimmer: 65%. – Fetma (BMI ≥30): 43%. |
| Resultat | – 21% minskning av primärt utfall (HR 0,79, 95% CI 0,69–0,90). – 27% minskning av hjärtsviktssjukhusvårdningar. – Stabiliserad njurfunktion (mindre eGFR-försämring). |
| Säkerhet | Vanligaste biverkningar: hypotoni (6%), urinvägsinfektion (9%). Ingen signifikant ökad risk för ketoacidos. |
Effekt på det primära utfallsmåttet
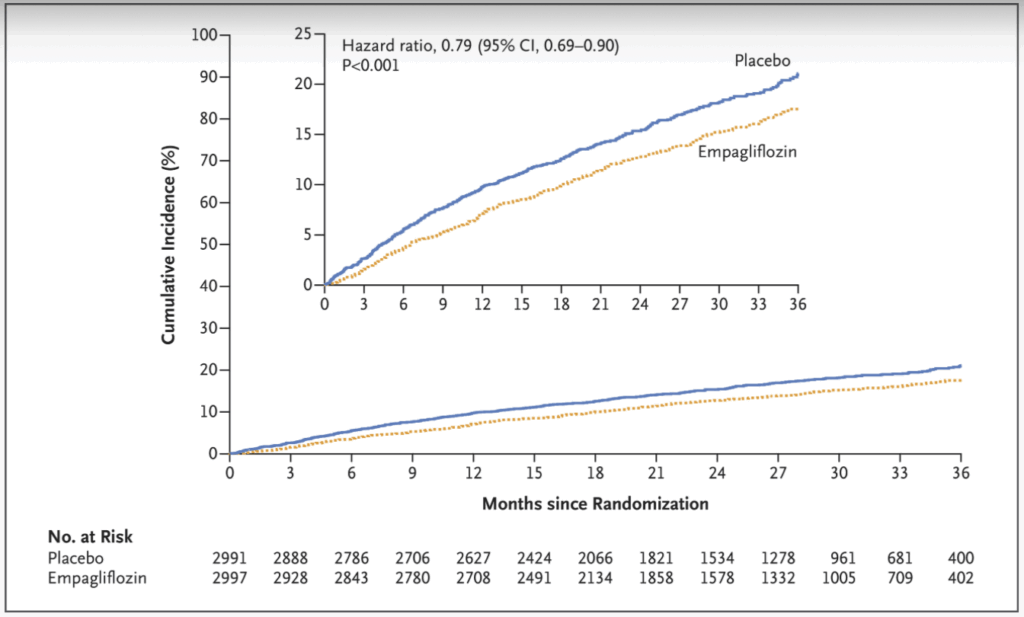
I EMPEROR-Preserved noterade man en 21 procent minskning hos individer som behandlades med Jardiance jämfört med placebo vad gäller tid till kardiovaskulär död eller förvärrad hjärtsvikt (krävande intravenös behandling eller sjukhusvård).
Relativa riskmått för EMPEROR-Preserved
| Utfall | Empagliflozin-grupp Antal (%) | Incidens per 100 patientår | Placebogrupp Antal (%) | Incidens per 100 patientår | Hazardkvot (HR) 95% KI | p-värde |
|---|---|---|---|---|---|---|
| Primärt sammansatt utfall | 415 (13,8%) | 6,9 | 511 (17,1%) | 8,7 | 0,79 (0,69–0,90) | <0,001 |
| Inläggning för hjärtsvikt | 259 (8,6%) | 4,3 | 352 (11,8%) | 6,0 | 0,71 (0,60–0,83) | – |
| Kardiovaskulär död | 219 (7,3%) | 3,4 | 244 (8,2%) | 3,8 | 0,91 (0,76–1,09) | – |
EMPA-REG-OUTCOME
Tabell: EMPA-REG OUTCOME studien
| Kategori | Detaljer |
|---|---|
| Inklusionskriterier | – Vuxna (≥18 år) med typ 2-diabetes (HbA1c 7–10%). – Etablerad hjärt-kärlsjukdom. – BMI ≤45 kg/m². |
| Baseline-data | – Deltagare: 7 020 patienter. – Ålder: Medel 63 år. – Kön: 72% män. – HbA1c: 8,1%. – BMI: 30,7 kg/m². – Diabetesduration: >10 år (57%). |
| Komorbiditeter | – Hypertoni (80–90%). – Tidigare hjärtinfarkt (48%). – Kronisk njursjukdom (eGFR <60: 26%). – Hjärtsvikt (10%). |
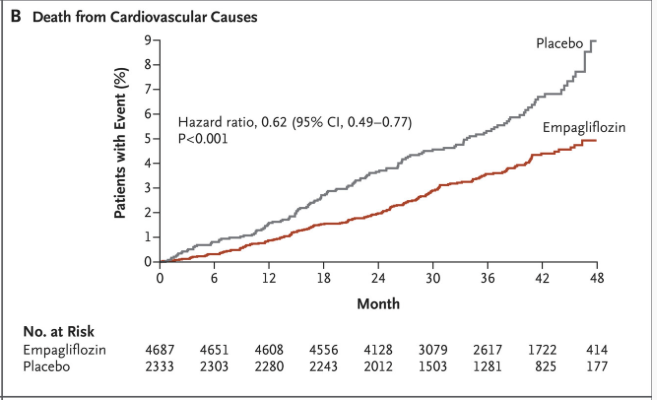
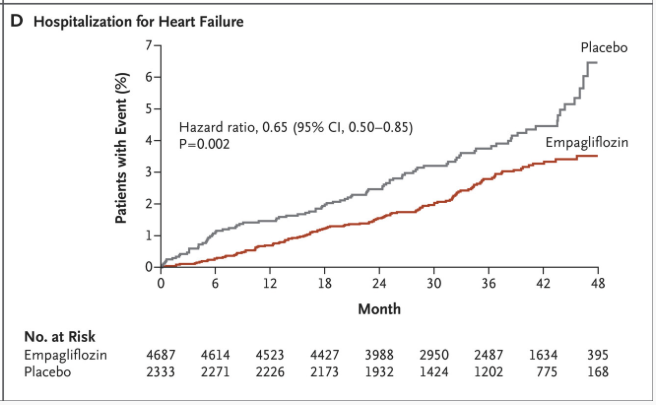
| Primära resultat | 3-poängs MACE (kardiovaskulär död, icke-dödlig hjärtinfarkt/stroke): – Riskminskning 14% (HR 0,86). |
| Sekundära resultat | – Total dödlighet: 32% minskning. – Hjärtsviktssjukhusvistelse: 35% minskning. – Förbättrade njurresultat. – Död av kardiovaskulära händelser: 38% minskning. |
| Säkerhet | – Ökad risk för genitala infektioner. – Ingen ökad hypoglykemi. – Sällsynt ketoacidos (0,1%). |
Effekt på det sekundära utfallsmåttet
Dapagliflozin (dapagliflozin)
Kliniska prövningar som undersökt effekten av Dapagliflozin för hjärtsvikt är följande: DAPA-HF, DELIVER och DAPA-CKD.
DAPA–HF
DAPA-HF (2019) visade först att dapagliflozin signifikant förbättrar prognosen vid HFrEF. I DAPA-HF randomiserades 4 744 patienter med LVEF ≤40% (varav ~42% hade typ 2-diabetes) till dapagliflozin 10 mg dagligen eller placebo utöver standardterapi. Efter mediant 18 månaders uppföljning hade primärutfallet – en kombination av kardiovaskulär död eller försämrad hjärtsvikt (sjukhusinläggning eller akut hjärtsviktsbesök) – inträffat hos 16,3% i dapagliflozin-gruppen vs 21,2% i placebogruppen (p < 0,001).
Detta motsvarade en relativ riskreduktion på ~26% (HR ≈0,74, 95% KI ~0,65–0,85). Vikten av fyndet underströks av att effekten sågs oavsett diabetesstatus; ungefär hälften av patienterna hade inte diabetes, men dapagliflozin minskade utfallen i samma storleksordning även hos dessa. Dessutom sågs en signifikant minskning av kardiovaskulär död med ~18% (HR 0,82; 95% KI 0,69–0,98) i dapagliflozin-gruppen. Sekundära utfall visade färre sjukhusinläggningar för hjärtsvikt (9,7% vs 13,4%) och en trend mot långsammare njurfunktionsförsämring med dapagliflozin.
Tabell: DAPA-HF-Studien
| Kategori | Detaljer |
|---|---|
| Inklusionskriterier | – Vuxna med HFrEF (LVEF ≤40%). – NYHA-klass II–IV. – Höga NT-proBNP-nivåer. – Stabil hjärtsviktbehandling. |
| Baseline-data | – Deltagare: 4 744. – Ålder: 66 år (medel). – Kön: 78% män. – LVEF: 31%. – NT-proBNP: 1 437 pg/mL. – Diabetes: 45%. |
| Komorbiditeter | – Ischemisk hjärtsjukdom (56%). – Hypertoni (67%). – Kronisk njursjukdom (41%). |
| Primärt utfall | Sammansatt av förvärrad hjärtsvikt/kardiovaskulär död: – Riskminskning 26% (HR 0,74). |
| Sekundära utfall | – Allmän dödlighet: 17% minskning. – Färre akuta hjärtsviktbesök (30% minskning). |
| Säkerhet | – Ökad risk för genitala infektioner. – Ingen ökad hypoglykemi/benfrakturer. – Sällsynt ketoacidos. |
Effekt på det sekundära utfallsmåttet
Effekt på det sekundära utfallsmåttet
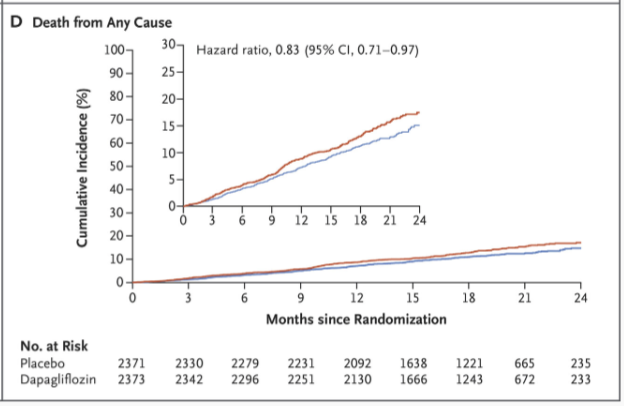
DELIVER
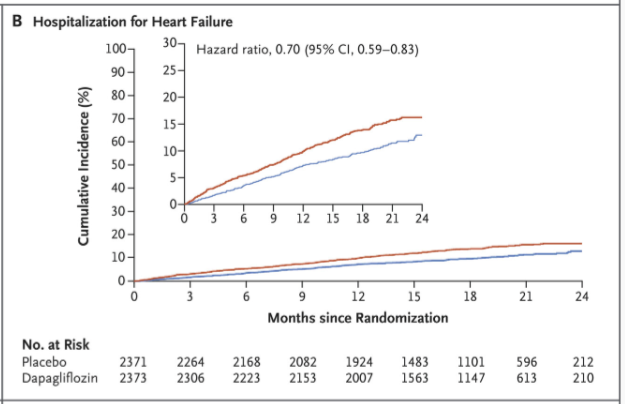
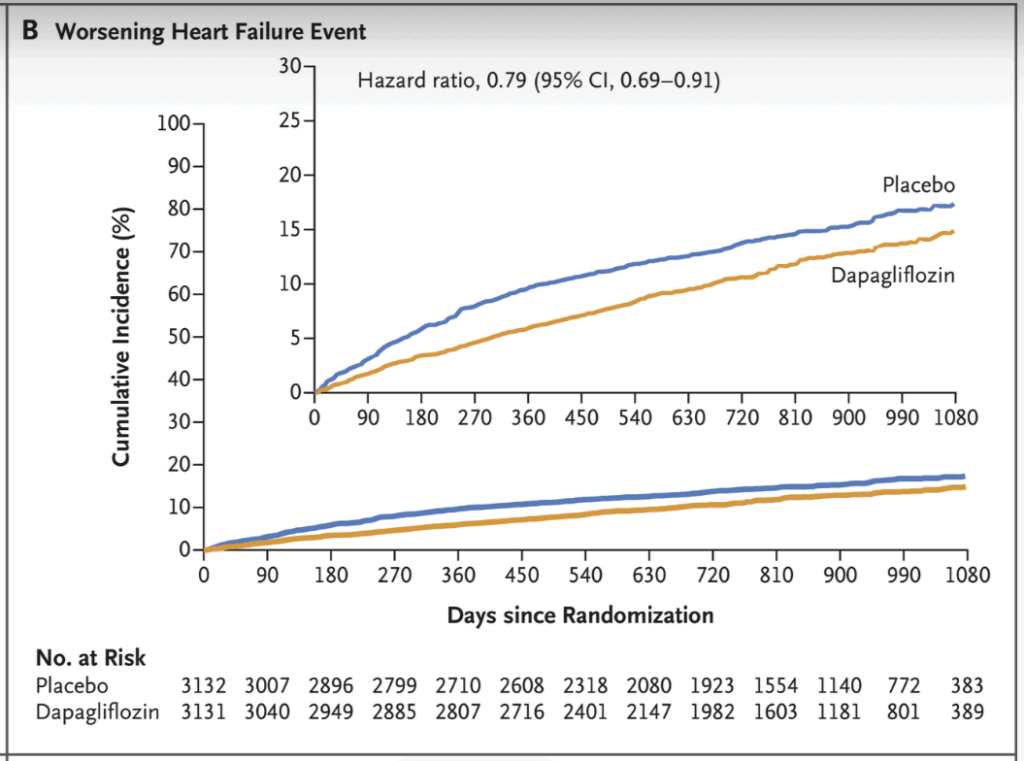
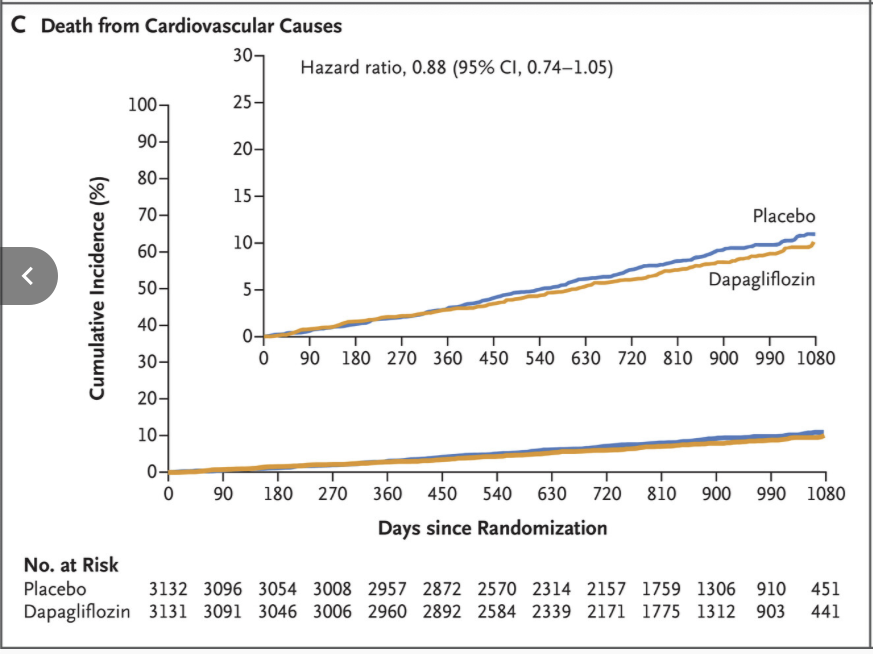
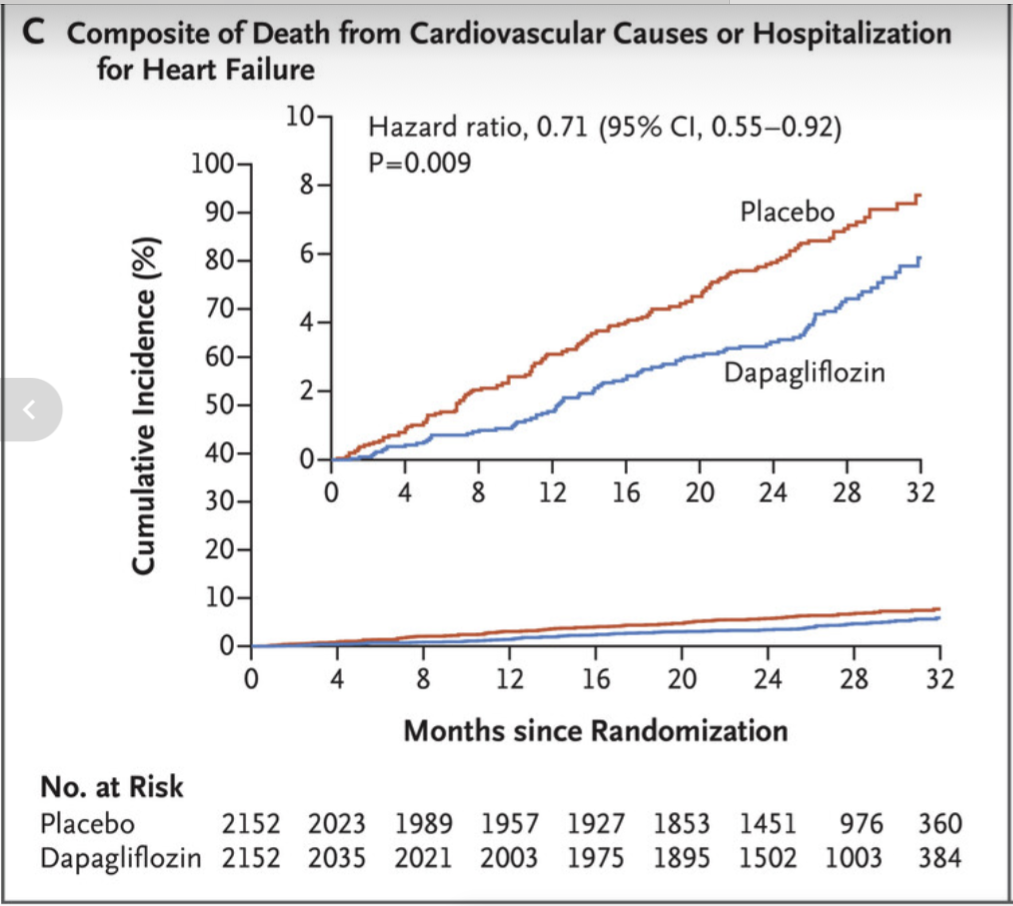
DELIVER (2022) undersökte dapagliflozin hos 6 263 patienter med HF med mildly reduced or preserved EF (definierat som LVEF >40% i inklusionskriteriet). Resultaten överensstämmer nära med EMPEROR-Preserved. Dapagliflozin minskade primärutfallet (försämrad hjärtsvikt som kräver sjukhusvård eller akutbesök, eller kardiovaskulär död) till 16,4% jämfört med 19,5% i placebogruppen (HR 0,82; 95% KI 0,73–0,92; p<0,001).
Detta motsvarar ~18% relativ riskreduktion, i linje med empagliflozinens ~21% i HFpEF. Effekten var konsekvent oavsett samtidig typ 2-diabetes och över olika EF-kategorier (inklusive både HFmrEF och EF ≥60%).
Precis som med empagliflozin var riskreduktionen i DELIVER huvudsakligen driven av färre hjärtsviktsrelaterade inläggningar, medan ingen signifikant minskning av kardiovaskulär död eller total dödlighet sågs isolerat.
Kombinerade analyser av HFpEF-studierna bekräftar en klass-effekt: en metaanalys av EMPEROR-Preserved och DELIVER visade ~20% lägre risk för hjärtsviktsrelaterade händelser med SGLT2-hämmare även vid LVEF >40%, utan heterogenitet mellan studierna.
Tabell: DELIVER-Studien
| Kategori | Detaljer |
|---|---|
| Inklusionskriterier | – Vuxna med HFpEF/HFmrEF (LVEF >40%). – NYHA-klass II–IV. – Höga NT-proBNP-nivåer. – Stabil hjärtsviktbehandling. |
| Baseline-data | – Deltagare: 6 263. – Ålder: 72 år (medel). – Kön: 44% kvinnor. – LVEF: 54%. – NT-proBNP: 1 429 pg/mL. – Diabetes: 45%. |
| Komorbiditeter | – Hypertoni (82%). – Förmaksflimmer (43%). – Kronisk njursjukdom (48%). |
| Primärt utfall | Sammansatt av förvärrad hjärtsvikt/kardiovaskulär död: – Riskminskning 18% (HR 0,82). |
| Sekundära utfall | – 21% minskning av hjärtsviktförsämringar. – Förbättrad symtomkontroll (KCCQ). |
| Säkerhet | – Ökad risk för genitala infektioner. – Ingen ökad hypoglykemi/benfrakturer. – Sällsynt ketoacidos. |
Effekt på det sekundära utfallsmåttet
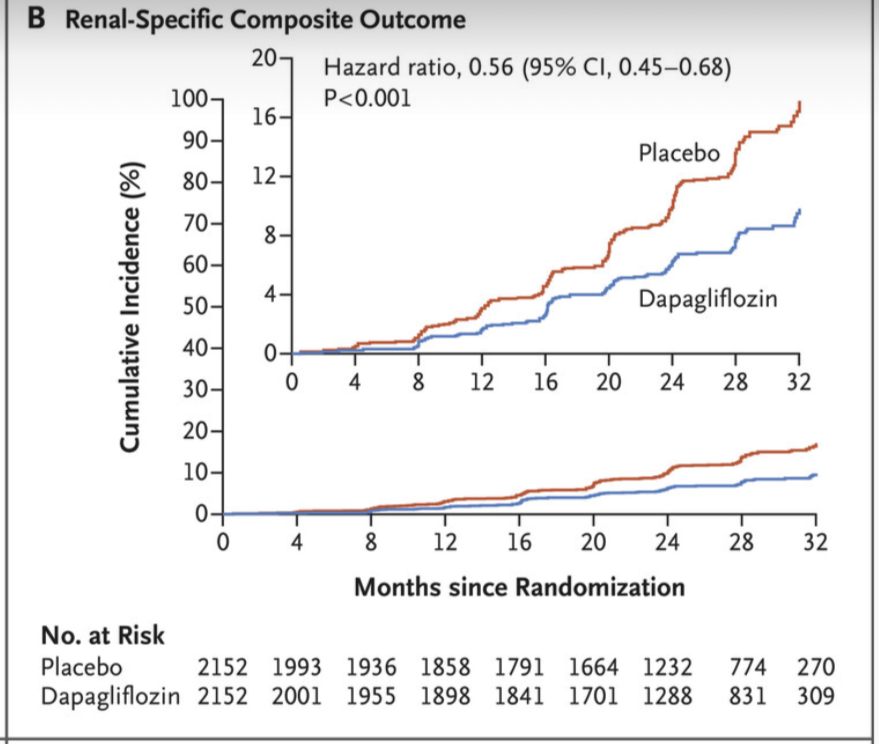
DAPA–CKD
Tabell: DAPA-CKD studien
| Kategori | Detaljer |
|---|---|
| Inklusionskriterier | – Vuxna med CKD (eGFR 25–75, UACR ≥200 mg/g). – Med eller utan diabetes. – Stabil ACE-hämmare/ARB-behandling. |
| Baseline-data | – Deltagare: 4 304. – Ålder: 62 år (medel). – Kön: 67% män. – eGFR: 43 mL/min/1,73m². – UACR: 949 mg/g. – Diabetes: 67%. |
| Komorbiditeter | – Hypertoni (89%). – Tidigare hjärt-kärlhändelse (25%). |
| Primärt utfall | Sammansatt av njursvikt/död: – Riskminskning 39% (HR 0,61). |
| Sekundära utfall | – 29% minskning av hjärtsviktssjukhusvistelse. – 31% minskad dödlighet. |
| Säkerhet | – Ökad risk för genitala infektioner. – Ingen ökad hypoglykemi/benfrakturer. – Sällsynt ketoacidos. |
Effekt på det sekundära utfallsmåttet
Slutsats
Tabell: Jämförelse av stora kliniska prövningar med dapagliflozin vs. empagliflozin
| Kategori | Dapagliflozin | Empagliflozin |
|---|---|---|
| Huvudstudier | DAPA-HF, DELIVER, DAPA-CKD | EMPA-REG OUTCOME, EMPEROR-Reduced, EMPEROR-Preserved |
| Population | – HFrEF (LVEF ≤40%) – HFpEF (LVEF >40%) – CKD (med/utan diabetes) | – Typ 2-diabetes + CVD (EMPA-REG) – HFrEF (EMPEROR-Reduced) – HFpEF (EMPEROR-Preserved) |
| Primärt utfall | HFrEF: 26% ↓ hjärtsvikt/död (DAPA-HF) HFpEF: 18% ↓ (DELIVER) CKD: 39% ↓ njursvikt/död (DAPA-CKD) | T2D + CVD: 14% ↓ MACE (EMPA-REG) HFrEF: 25% ↓ hjärtsvikt/död (EMPEROR-Reduced) HFpEF: 21% ↓ (EMPEROR-Preserved) |
| Kardiovaskulär död | – HFrEF: 18% ↓ (DAPA-HF) – HFpEF: 12% ↓ (DELIVER) | – T2D + CVD: 38% ↓ (EMPA-REG) – HFrEF: 8% ↓ (EMPEROR-Reduced) |
| Hjärtsviktssjukhusvistelse | – HFrEF: 30% ↓ (DAPA-HF) – HFpEF: 21% ↓ (DELIVER) – CKD: 29% ↓ (DAPA-CKD) | – HFrEF: 31% ↓ (EMPEROR-Reduced) – HFpEF: 27% ↓ (EMPEROR-Preserved) |
| Allmän dödlighet | – HFrEF: 17% ↓ (DAPA-HF) – CKD: 31% ↓ (DAPA-CKD) | – T2D + CVD: 32% ↓ (EMPA-REG) |
| Njurrelaterade utfall | CKD: 44% ↓ dialys/transplantation (DAPA-CKD) | T2D + CVD: 46% ↓ njurprogress (EMPA-REG) |
| Säkerhetsprofil | – Genitala infektioner (2–5%) – Volymdepletion (5–6%) – Sällsynt ketoacidos | – Genitala infektioner (6%) – Ingen ökad UVI/benfrakturer – Sällsynt ketoacidos |
| Unika fördelar | – Effektiv vid alla LVEF-nivåer (HFrEF + HFpEF) – Starkt njurskydd | – Tidigast visad CV-dödssänkning vid T2D – Reduktion av stroke (EMPA-REG) |
Jämförande analyser tyder på att båda substanserna ger likvärdiga kliniska resultat – ingen signifikant skillnad i effektstorlek har kunnat påvisas mellan empagliflozin och dapagliflozin, och båda rekommenderas likvärdigt i internationella riktlinjer.
Små differenser i enskilda utfall (t.ex. dapagliflozins signifikanta mortalitetssänkning i en studie vs. empagliflozins något större relativa riskreduktion i HFpEF) är av tveksam klinisk betydelse och överlag överskuggas de av den konsistenta klass-effekten av SGLT2-hämning.
Beträffande patientselektion finns det få begränsningar – såväl diabetiker som icke-diabetiker, överviktiga som normalviktiga, yngre som äldre, ischemisk som icke-ischemisk etiologi, och patienter med måttlig njursvikt har alla visat tydlig nytta av behandlingen.
Preparaten tolereras väl; de medför ingen ökning av allvarliga biverkningar jämfört med placebo och de vanligaste sidoeffekterna (lindriga genitala infektioner) är hanterbara. Förskrivaren bör vara medveten om sällsynta risker som ketoacidos hos diabetiker och informera patienten, men dessa risker förändrar inte den positiva risk–nytta-balansen.
SGLT2-hämmarna erbjuder ett nytt angreppssätt: genom en kombination av modest diures, metabol omställning (ökade ketoner) och organskyddeffekter i hjärta och njure förbättrar de hjärtsviktspatientens prognos på flera fronter samtidigt. Den exakta mekanismen bakom den prognosförbättring som ses är ännu föremål för intensiv forskning, men troligen multifaktoriell och additiv till traditionella terapier.
Nyckelskillnader
- Population:
- Dapagliflozin: Fokuserar på bred hjärtsvikt (HFrEF + HFpEF) och CKD.
- Empagliflozin: Starkt fokus på typ 2 diabetes + CVD och separata HFrEF/HFpEF-studier.
- Dödlighet:
- Empagliflozin: Starkast bevis för minskad CV-död vid T2D (EMPA-REG).
- Dapagliflozin: Bred dödlighetsminskning i HFrEF + CKD.
- Njurar:
- Båda visar njurskydd, men Dapagliflozin har dedikerad CKD-studie (DAPA-CKD).
- Säkerhet:
- Liknande biverkningsprofiler, men Empagliflozin har högre frekvens genitala infektioner.
Slutlig rekommendation
- Vid hjärtsvikt: empagliflozin och dapagliflozin är lika effektiva, men dapagliflozin har data för hela spektrumet.
- Vid T2D + CVD: Empagliflozin har bäst evidens för CV-död.
- Vid CKD: Dapagliflozin har starkast njurskyddande effekt.
Hjärtsvikt med reducerad EF:
DAPA-HF utvärderade dapagliflozin hos 4 744 patienter med HFrEF (LVEF ≤40%). Dapagliflozin minskade det primära utfallet (kardiovaskulär död eller förvärrad hjärtsvikt) med 26% relativt placebo (HR 0,74; 95% CI 0,65–0,85; p<0,001). Den absoluta riskreduktionen var ~5% (16,3% vs 21,2% drabbades), vilket motsvarar NNT ≈ 21 över 18 månader. Effekten sågs hos både diabetiker och icke-diabetiker. Dapagliflozin gav också färre sjukhusinläggningar för hjärtsvikt (HR ~0,70) och en trend mot lägre kardiovaskulär död (9,6% vs 11,5%; HR ~0,82).
– EMPEROR-Reduced prövade empagliflozin hos 3 730 patienter med HFrEF (NYHA II–IV, LVEF ≤40%). Empagliflozin visade likvärdig riskreduktion som dapagliflozin: det primära utfallet (CV-död eller hjärtsviktssjukhusvård) inträffade hos 19,4% på empagliflozin mot 24,7% på placebo (HR 0,75; 95% CI 0,65–0,86; p<0,001). Även här drevs vinsten främst av färre sjukhusinläggningar för hjärtsvikt. Ingen statistiskt signifikant minskning av enbart kardiovaskulär död sågs (empagliflozin gav ~8% relativ riskreduktion för CV-död, HR ~0,92, 95% CI 0,75–1,12), men totalmortaliteten var numeriskt lägre.
Hjärtsvikt med bevarad EF:
EMPEROR-Preserved inkluderade 5 988 patienter med HFpEF/HFmrEF (LVEF >40%). Empagliflozin blev första behandlingen att signifikant förbättra utfall vid HFpEF. Primärutfallet (CV-död eller HF-inläggning) inträffade hos 13,8% på empagliflozin vs 17,1% på placebo (HR 0,79; 95% CI 0,69–0,90; p<0,001) – en relativ riskminskning på ~21%. Vinsten berodde främst på färre hjärtsviktssjukhus (29% reduktion) medan effekten på kardiovaskulär död var modest. Subgruppsanalys indikerade att patienter i gråzonen LVEF 40–50% hade minst lika stor nytta (HR ~0,71). Effekten var konsistent oavsett diabetes.
DELIVER studerade dapagliflozin vid HFpEF/HFmrEF (LVEF >40%, inkl. även patienter med tidigare låg EF som förbättrats). Resultaten bekräftade EMPEROR-Preserved: dapagliflozin sänkte risken för förvärrad hjärtsvikt eller CV-död med ~18% relativt placebo (16,4% vs 19,5%; HR 0,82; 95% CI 0,73–0,92; p<0,001). Ingen signifikant skillnad sågs i CV-död isolerat (HR 0,88; 95% CI 0,74–1,05), men totalutfallet förbättrades tydligt över hela EF-spektrumet.
Typ 2 diabetes + CVD: SGLT2-hämmare och kardiovaskulär död
EMPA-REG OUTCOME: Den första stora kardiovaskulära utfallsstudien för SGLT2-hämmare inkluderade >7 000 patienter med typ 2 diabetes och etablerad aterosklerotisk hjärtsjukdom. Efter ~3,1 års uppföljning fann man att empagliflozin signifikant minskade risken för kardiovaskulära händelser och särskilt död.
Kardiovaskulär mortalitet reducerades med 38% relativt placebo (3,7% vs 5,9% av patienterna; RR ~0,62; 95% CI 0,50–0,78). Detta var en högst signifikant skillnad (p<0,001).
Även totalmortaliteten minskade med ~32% (RR 0,69; 95% CI 0,58–0,82). Empagliflozin uppnådde dessutom en 14% reduktion av 3-punkts MACE (major adverse cardiac events; HR 0,86; 95% CI 0,74–0,99; p=0,04).
Det mest anmärkningsvärda fyndet var dock den tydliga minskningen av hjärtdöd – en effekt som sågs tidigt under studiens gång och bibehölls. Som kontext hade tidigare diabetesstudier med andra läkemedel (t.ex. DPP4-hämmare, GLP-1-agonister pre-2015) intekunnat påvisa någon mortalitetsvinst. EMPA-REG markerade därför ett genombrott.
Dapagliflozin (DECLARE-TIMI 58): DECLARE studerade dapagliflozin hos en bredare T2D-population (17 160 patienter, varav ~40% med etablerad CVD och 60% enbart riskfaktorer). Här visade dapagliflozin ingen signifikant skillnad i 3-punkts MACE jämfört med placebo (HR 0,93; 95% CI 0,84–1,03; endast non-inferiority uppnåddes).
Följaktligen sågs ingen minskning av kardiovaskulär död i denna heterogena population – CV-död inträffade hos ~2,9% i båda grupper (ingen statistisk skillnad). Däremot nådde dapagliflozin i DECLARE en av sina två primära effektparametrar: kombinationen CV-död eller sjukhusinläggning för hjärtsvikt minskade signifikant (4,9% vs 5,8%; HR 0,83; 95% CI 0,73–0,95).
SGLT2-hämmare och njursvikt
Dapagliflozin har visat mycket stark njurskyddande effekt i CKD, vilket motiverar påståendet. I synnerhet DAPA-CKD-resultatenär anmärkningsvärda med ~39% riskreduktion för njursvikt eller död och signifikant överlevnadsvinst.
Empagliflozin och canagliflozin visar dock liknande förmåga att skydda njurarna (HR ~0,7 i sina studier). Det handlar således om en klass-effekt av SGLT2-hämmare på njurarna. Dapagliflozin var först ut och inkluderade även patienter utan diabetes, varför dess evidens ansågs starkast initialt.
Men med aktuell evidensbasis (2019–2023) bör man säga att alla SGLT2-hämmare med prövad indikation ger kraftigt njurskydd, och inget data talar för att just dapagliflozin farmakologiskt skulle skydda njurarna bättre än empagliflozin – båda bör ses som likvärdiga alternativ för CKD-patienter.
Det innebär att dapagliflozin har mycket robust data och en bred CKD-indikation, men empagliflozin har nu uppvisat likvärdig njurnytta i studier, och behandlingsriktlinjer rekommenderar SGLT2-hämmare generellt som standardterapi vid proteinurisk kronisk njursjukdom för att bromsa progress och reducera mortalitet.