Kontinuerlig glukosmätning vid graviditetsdiabetes (DipGluMo-studien)
Bakgrund
Graviditetsdiabetes (diabetes som upptäcks under graviditeten) är en av de vanligaste komplikationerna under graviditet och drabbar globalt upp till omkring 14 % av alla gravida. Grundtanken i behandlingen är att god blodsockerkontroll (glykemisk kontroll; att hålla glukosnivåerna inom målområdet) minskar risken för ogynnsamma utfall för mor och barn.
Traditionellt har detta uppnåtts genom egenkontrollerade kapillära blodsockermätningar (SMBG; self-monitoring of blood glucose; fingerstick med glukosmätare flera gånger dagligen). Under de senaste två decennierna har realtids-kontinuerlig glukosmätning (rtCGM; real-time continuous glucose monitoring; en sensor under huden som kontinuerligt mäter glukos i vävnadsvätska och visar värden i realtid) blivit vanligare.
Tekniken är lovande eftersom den fångar upp mönster och svängningar som annars kan missas med punktmätningar och kan därmed teoretiskt leda till bättre styrning av kost, fysisk aktivitet och insulin under graviditeten. Samtidigt har studier på just graviditetsdiabetes givit blandade resultat, och någon internationell konsensus om när och hur rtCGM bör användas saknas.
DipGluMo-studien från Schweiz – en öppen, randomiserad och kontrollerad prövning – adresserar denna fråga genom att jämföra rtCGM med standardbehandling med SMBG och utvärdera effekter på perinatala och neonatala utfall (perioden kring födseln respektive barnets första levnadsdygn).
Metoder
Studiedesign och deltagare
DipGluMo var en öppen (open-label; både deltagare och vårdteam visste vilken metod som användes), enkelcentrerad, randomiserad, kontrollerad studie genomförd vid ett universitetssjukhus i Bern, Schweiz. Gravida i åldern 18–45 år inkluderades mellan graviditetsvecka 24 och 28 efter att ha diagnostiserats med graviditetsdiabetes enligt IADPSG-kriterierna (International Association of Diabetes and Pregnancy Study Groups; en standardiserad 75 g oralt glukostoleranstest (OGTT) med definierade gränser för fastande, 1-timme och 2-timmars glukos).
Endast enkelbörd (singelgraviditet) utan påvisade fostermissbildningar i andra trimestern inkluderades. Samtliga deltagare fick sedvanlig livsstilsrådgivning om kost och fysisk aktivitet; HbA1c (långtidssocker; ett mått på genomsnittlig glukosnivå de senaste 8–12 veckorna) skulle vara < 6,5 % (48 mmol/mol) vid inklusion. Studien registrerades (NCT05037526) och etikgodkändes; samtliga deltagare gav skriftligt samtycke.
Randomisering
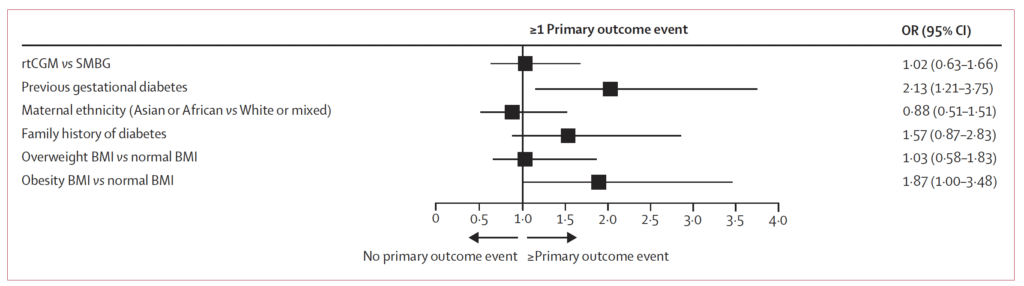
Deltagarna lottades 1:1 till rtCGM (intervention) eller SMBG (kontroll). Stratifiering skedde efter tidigare graviditetsdiabetes, förstagradssläkting med typ 2-diabetes, etnicitet och BMI (kroppsmasseindex) före graviditeten, för att balansera kända riskfaktorer mellan grupperna.
Designen var öppen, men kontrollgruppen bar dessutom en blindadrtCGM-sensor under tre kortare perioder (vid inklusion, i graviditetsvecka 34–38 och postpartum) enbart för datainsamling och upplevd användbarhet, utan att få se värdena i realtid.
Interventioner och uppföljning
Interventionsgruppen använde en Dexcom G6-sensor (rtCGM) kontinuerligt under graviditeten med målområde 3,5–7,8 mmol/L (”time-in-range” avser andelen tid glukos ligger i målområdet). Kontrollgruppen utförde kapillära glukosmätningar sex gånger dagligen (före och 1 timme efter måltider) med mål ≤ 5,3 mmol/L fastande/före måltid och ≤ 8,0 mmol/L 1 timme efter måltid.
Besöken var förlagda till ordinarie mödravårdsbesök ungefär varannan vecka, då bl.a. blodtryck, vikt, proteinuri (äggvita i urinen; tecken på preeklampsi), fostervattenmängd, uppskattad fostervikt och eventuell insulinbehandling dokumenterades.
Neonatala utfall som hypoglykemi (lågt blodsocker; < 2,5 mmol/L inom 2–4 timmar efter födseln), behov av neonatal intensivvård (NICU; neonatal intensivvårdsavdelning) och andningsstöd (t.ex. CPAP; continuous positive airway pressure; andningsstöd med övertryck) registrerades. Postpartum (6–8 veckor efter förlossning) gjordes HbA1c och ett nytt OGTT för att bedöma kvarstående glukosrubbning.
Utfallsmått
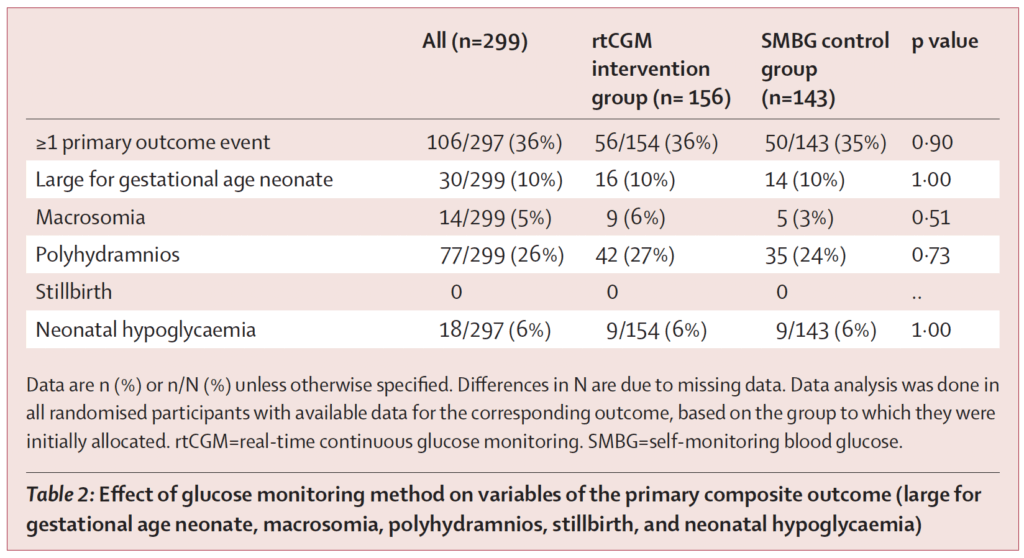
Det primära utfallet var en sammansatt måttkorg av viktiga graviditets- och neonatalutfall: andel barn stora för graviditetslängden (LGA; large for gestational age; födelsevikt över 90:e–95:e percentilen), makrosomi (mycket hög födelsevikt; > 95:e percentilen), polyhydramnios (för mycket fostervatten; maximal vertikal ficka > 8 cm), neonatal hypoglykemi samt intrauterin fosterdöd/stillbirth (fetal död före födseln).
Sekundära utfall inkluderade glykemiska mått (t.ex. tid i målområde, medelglukos, glykemisk variabilitet), insulinbehandling (behov och dos), obstetriska utfall såsom preeklampsi (graviditetsförgiftning; blodtryck ≥ 140/90 mmHg plus proteinuri eller tecken på organdysfunktion), förlossningssätt (vaginal, instrumentell eller kejsarsnitt), samt patientrapporterad preferens och tillfredsställelse. Säkerhet registrerades som hudreaktioner och andra biverkningar.
Statistisk analys
Studien dimensionerades för att kunna påvisa en minskning av det primära sammansatta utfallet från 49 % till 32 % (80 % styrka, tvåsidigt alfa 0,05), vilket gav ett planerat urval på 302 patienter. Analyserna gjordes enligt intention-to-treat(ITT; alla analyseras i den grupp de lottats till oavsett faktisk användning). Odds-kvoter (OR) med 95 % konfidensintervall (KI) beräknades med logistisk regression, både ojusterat och justerat för stratifieringsvariablerna. P-värde < 0,05 sågs som statistiskt signifikant.
Resultat
Deltagare och grunddata
Mellan 29 september 2021 och 11 juni 2024 bedömdes 586 gravida; 302 randomiserades (156 till rtCGM och 143 till SMBG efter exklusioner/återtagna samtycken). Baslinjekaraktäristika var välbalanserade: medelålder cirka 33 år, medel-BMI runt 25,7–25,8 kg/m² och graviditetslängd vid inklusion cirka 27,7 veckor. HbA1c vid inklusion var lågt i båda grupper (runt 5,0–5,1 %), men saknades hos en större andel eftersom 66 % avböjde blodprov vid just inklusion. Besöksföljsamheten var hög och likartad.
Primärt utfall – perinatala/neonatala händelser
Det sammansatta primära utfallet inträffade hos 36 % i rtCGM-gruppen och 35 % i SMBG-gruppen. Skillnaden var icke-signifikant, både i ojusterad analys (OR 1,06; 95 % KI 0,66–1,71; p = 0,80) och efter justering för stratifieringsvariablerna (OR 1,02; 95 % KI 0,63–1,66).
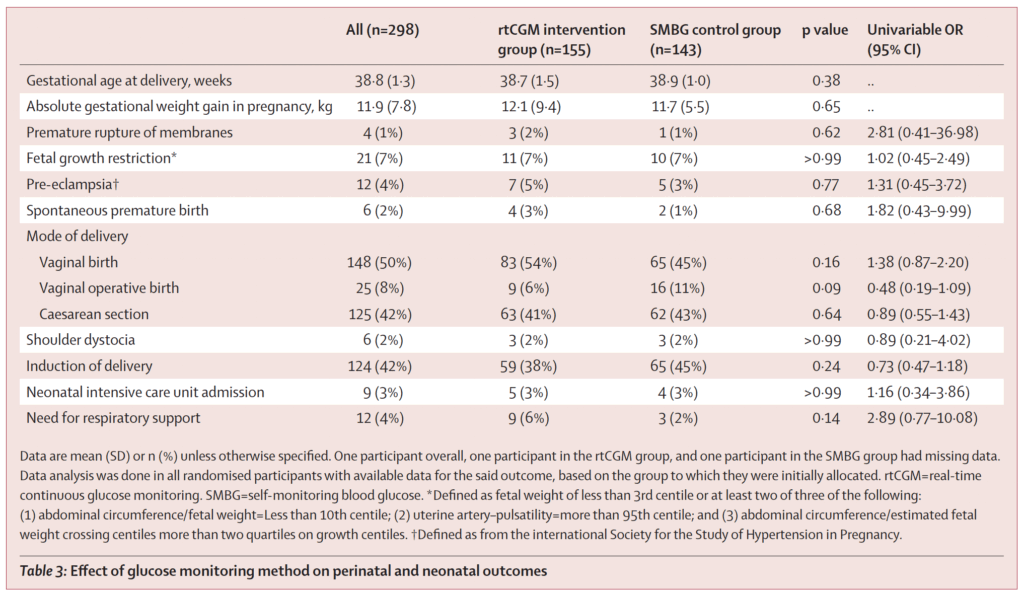
Delkomponenterna i det primära utfallet såsom stor fostervikt vid födsel, makrosomi, polyhydramnios, neonatal hypoglykemi och stillbirth var för sig också likartade mellan grupperna. Notabelt fanns inga stillbirths i något av leden. Dessa fynd talar för att rtCGM inte förbättrade de samlade kliniska utfallen jämfört med väl genomförd SMBG i denna population.
Obstetriska utfall och förlossningssätt
Graviditetslängd vid förlossning var omkring 38 + 5 veckor i båda grupperna. Viktuppgång under graviditeten skilde sig inte signifikant. Preeklampsi var ovanligt och förelåg hos 5 % (rtCGM) respektive 3 % (SMBG); skillnaden var inte signifikant. Förekomst av fetal tillväxthämning (FGR; fetal growth restriction; nedsatt fostertillväxt enligt internationella ultraljudskriterier) var 7 % i båda grupper.
Andelen prematur födsel (före 37 veckor) var låg och likartad. Förlossningssätt (vaginal/instrumentell/kejsarsnitt), igångsättning samt behov av neonatal intensivvård eller andningsstöd uppvisade inga meningsfulla skillnader. Sammantaget visar detta att rtCGM inte översattes i obstetrisk fördel mätt med etablerade kliniska utfall.
Glykemiska parametrar och sensoranvändning
Jämförelser av kontinuerliga glukosmått komplicerades av att kontrollgruppen bar blindad sensor endast under korta fönster (inträde, vecka 34–38 och postpartum), och dessutom tackade 43 % i kontrollgruppen nej till minst en mätperiod. Interventionsgruppen bar rtCGM kontinuerligt i i genomsnitt 67 dagar med cirka 92–94 % aktiv sensortid.
Vid inklusion sågs inga signifikanta skillnader i tid i målområde eller medelglukos. I sen graviditet (vecka 34–38) hade SMBG-gruppen högre andel tid i målområde (96,9 % ± 3,0) än rtCGM-gruppen (92,2 % ± 7,1; p = 0,02), vilket kan spegla både urvalseffekter och designskillnaden i mätperioder. Allvarliga hypoglykemier rapporterades inte i någon grupp. Postpartum var medelinterstitiellt glukos, variabilitet och tid i målområdet jämförbara bland dem som hade data.
Insulinbehandling
Trots livsstilsstöd krävde en stor andel insulinbehandling (totalt 48 %). Andelen som fick insulin var numeriskt högre i rtCGM-gruppen (55 %) än i SMBG-gruppen (45 %), men skillnaden nådde inte signifikans (OR 1,24; 95 % KI 0,79–1,96).
Däremot påbörjades insulin i genomsnitt något tidigare i kontrollgruppen (31,8 ± 3,2 veckor) än i rtCGM-gruppen (30,6 ± 3,0 veckor; p = 0,02). Ingen deltog behandlades med metformin eller andra perorala antidiabetika.
Dessa mönster antyder att behandlingspraxis och trösklar (fördefinierade i protokollet: t.ex. tid-i-mål < 85 % i rtCGM-gruppen) kan ha påverkat beslut om insulinstart snarare än att rtCGM i sig förbättrade glykemisk kontroll så att behovet minskade.
Biverkningar, tolerabilitet och preferenser
Hudreaktioner (rodnad, klåda, irritation) var sällsynta och överlag milda. De rapporterades hos 4 % i rtCGM-gruppen och < 1 % med synlig reaktion i kontrollgruppen (trots att 7 % beskrev klåda/smärta).
Deltagarna uttryckte en tydlig preferens för rtCGM vid utvärdering efter förlossningen; på en 10-gradig skala hade rtCGM högre uppskattning och bedömdes av interventionsgruppen som lättare att använda än fingerstick. Det talar för att rtCGM kan upplevas som smidigare och mindre belastande i vardagen, även om hårda kliniska utfall inte förbättrades.
Diskussion
DipGluMo-studien är, såvitt känt, den första randomiserade kontrollerade prövningen med tillräcklig statistisk styrka för att primärt utvärdera rtCGM:s effekt på perinatala utfall hos kvinnor med graviditetsdiabetes. Resultaten visar inga signifikanta fördelar för rtCGM jämfört med väl genomförd SMBG vad gäller den sammansatta utfallet eller dess enskilda komponenter (LGA, makrosomi, polyhydramnios, neonatal hypoglykemi, stillbirth).
Detta står i viss kontrast till erfarenheter från typ 1-diabetes i graviditet där rtCGM har associerats med förbättrad glykemikontroll och minskad risk för stor födelsevikt, men överensstämmer med flera mindre eller kortvariga studier i graviditetsdiabetes där effekten på kliniska utfall varit svår att påvisa. Samtidigt noterades i DipGluMo att rtCGM var uppskattat av deltagarna och upplevdes praktiskt enklare än fingerstick, vilket är relevant ur ett patientcentrerat perspektiv.
Varför sågs ingen förbättring i hårda utfall? En möjlig förklaring är att standardvården i studien var mycket intensiv i båda armar: täta besök, sex SMBG-mätningar per dag i kontrollgruppen och tydliga mål för glukos. Denna höga vårdnivå kan ha minimerat skillnader som i en mer ”vardaglig” kontext annars kunde framträda.
Dessutom var födelseutfallen överlag goda och incidensen av allvarliga komplikationer låg, vilket minskar utrymmet för förbättring. En annan faktor är metodologisk: kontrollgruppen bar sensor endast under korta fönster och en stor andel tackade nej till minst en session, vilket försvårar direkt jämförelse av kontinuerliga glykemidata mellan grupperna och kan introducera selektionsbias i de sekundära sensorvariablerna.
Slutligen kan de fördefinierade behandlingsalgoritmerna (t.ex. tid-i-mål < 85 % som insulinindikation i rtCGM-armen) ha lett till att skillnader i hur och när insulin sattes in delvis drevs av protokollet snarare än av faktisk underliggande sjukdomssvårighet, vilket i sin tur kan neutralisera eventuella ”rtCGM-fördelar” i kliniska utfall.
När resultaten jämförs med tidigare litteratur framträder en bild av att rtCGM i graviditetsdiabetes möjligen kan förbättra mjuka glykemimått i sen graviditet, men att detta inte robust översätts i färre perinatala komplikationer i randomiserade studier. Metaanalyser har antytt marginellt bättre glykemikontroll utan tydliga vinster i LGA, makrosomi eller neonatal hypoglykemi.
DipGluMo stärker därmed slutsatsen att rtCGM inte bör förväntas reducera hårda obstetriska eller neonatala utfall i en välfungerande mödravårdskontext – men att tekniken ändå kan ha värde för patienten genom förenklad egenvård, förbättrad adherence (följsamhet) och kanske möjliggörande av distansuppföljning/telemedicin.
För att bedöma detta krävs hälsoekonomiska analyser där kostnader för sensorer, uppföljning och eventuella besparingar (t.ex. färre besök) ställs mot varandra. Författarna efterlyser också individdata-metaanalyser för att harmonisera definitioner och metoder och minska heterogenitet mellan studier.
Studiens styrkor omfattar robust randomiserad design, tydlig ITT-analys, stor sample-storlek för området, samt mycket låg andel bortfall i primärutfallet. Begränsningarna inkluderar enkelcentrerat upplägg (vilket kan påverka generaliserbarhet), sensor-datagap i kontrollgruppen och en relativt låg genomsnittlig BMI i denna schweiziska kohort jämfört med många andra populationer där graviditetsdiabetes förekommer. Trots detta representerades flera etniska grupper, och båda armarna diagnostiserades och behandlades enligt samma tydliga riktlinjer, vilket gör jämförelsen inom studien robust.
Slutsatser och kliniska implikationer
DipGluMo-studien visar att hos kvinnor med graviditetsdiabetes leder realtids-kontinuerlig glukosmätning inte till förbättrade sammansatta perinatala eller neonatala utfall jämfört med väl genomförd egenkontroll med fingerstick, när båda grupper får strukturerad livsstilsbehandling och tät uppföljning.
rtCGM minskar inte andelen som behöver insulinbehandling och förbättrar inte utfallet vad gäller LGA, makrosomi, polyhydramnios, neonatal hypoglykemi eller stillbirth. Samtidigt upplevs rtCGM som lättare och mer attraktivt av många gravida, och säkerhetsprofilen var god med få och milda hudreaktioner.
Den praktiska tolkningen blir därför att rtCGM kan erbjudas som ett alternativ för att underlätta egenvården hos patienter som önskar eller har svårt att följa SMBG-rutiner, snarare än som ett medel för att säkert förbättra hårda kliniska utfall. Framtida forskning bör utvärdera hälsoekonomin och om tekniken kan integreras i telemedicinska arbetssätt utan att kompromissa med säkerheten, samt identifiera undergrupper som eventuellt kan ha nytta på utfallsnivå.
Källa: Amylidi-Mohr S, Zennaro G, Schneider S, m.fl. Continuous glucose monitoring in the management of gestational diabetes in Switzerland (DipGluMo): an open-label, single-centre, randomised, controlled trial.Lancet Diabetes & Endocrinology. 2025;13:591–599. Öppen tillgång (CC BY 4.0)