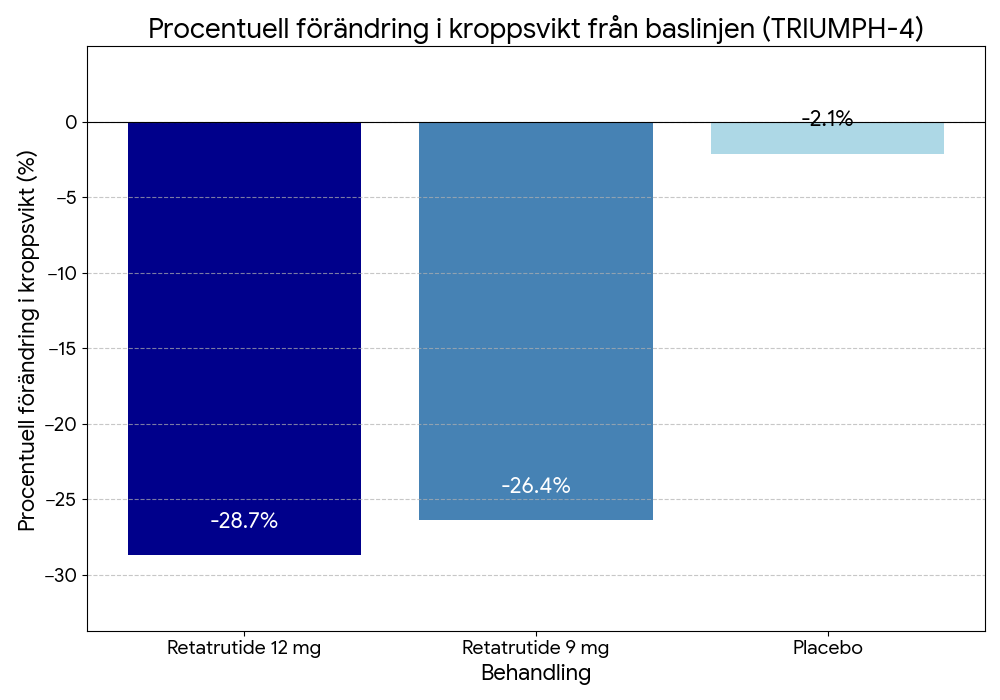
Ny era för typ 1 diabetes: svensk studie visar transplantation av beta-celler utan immunhämning
Bakgrund
Transplantation av beta-celler från en annan människa kräver normalt livslång immunosuppression (läkemedel som dämpar kroppens immunförsvar för att förhindra avstötning).
Sådan behandling är effektiv men medför betydande biverkningar och ökad sjuklighet. Vid typ 1 diabetes är standardbehandlingen insulin som tillförs utifrån via penna/pump. Intensiv insulinbehandling minskar komplikationer och förlänger liv, men är inte botande; många får fortfarande sämre livskvalitet, högre risk för hjärt-kärlsjukdom och kortare livslängd.
Forskare hare länge haft idén att återställa kroppens egen insulinproduktion med ö-cellstransplantation, vilket innebär transplantation av de insulinproducerande cellklumparna som kallar för Langerhanska öar, från en donator. Men immunavstötning och behov av immunhämning har begränsat användningen.
Genmodifiering
I experimentella modeller har forskare nyligen utvecklat en hypoimmun (”låg-igenkännbar” för immunsystemet) cellplattform (HIP) där donatorceller genredigeras så att de undgår T-cellsmedierad och medfödd avstötning.
Strategin kombinerar CRISPR–Cas12b-redigering (precis gengenredigering där man ”slår ut” specifika gener) av HLA klass I och HLA klass II (vävnadstypningsmolekyler som presenterar antigen för T-celler) med överuttryck av CD47 (ytprotein som fungerar som ”ät mig inte-signal” till fagocyterande celler och NK-celler).
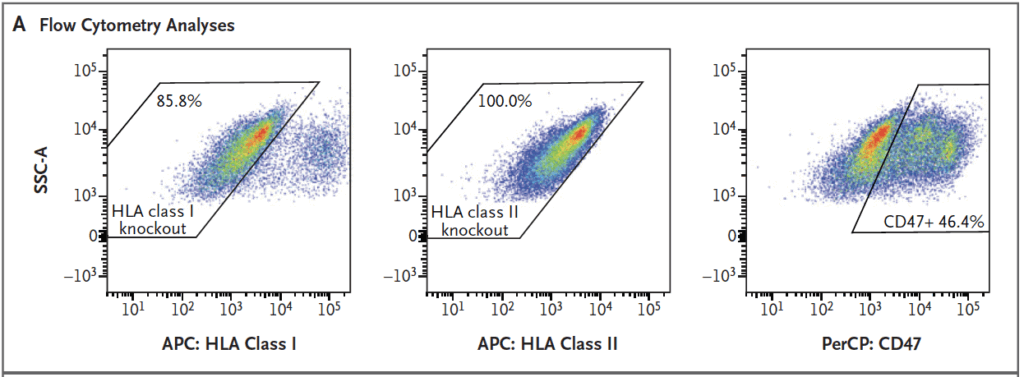
Figuren beskriver i fyra paneler hur ö-cellerna karakteriserades och gavs. Panel A visar flödescytometri (metod som mäter ytproteiner på enskilda celler) där staplar/punkter anger hur stor andel av cellerna som saknade HLA klass I(85,8 %) och HLA klass II (100 %) och hur många som hade högt CD47 (46,4 %).
Därmed undviks både adaptiv avstötning (T-cellsdriven) och medfödd avstötning via så kallad naturliga mördarceller, NK-celler, dödar celler som saknar HLA-ytmolekyler.
Prekliniska studier har visat långvarig överlevnad av sådana celler i humaniserade möss och i icke-mänskliga primater utan immunhämning. Den aktuella NEJM-rapporten beskriver första människofallet där genetiskt modifierade allogena ö-celler transplanterats utan immunhämmande läkemedel.
Metoder och studiedesign
Studien är en först-i-människa, proof-of-concept-prövning bestående av genredigerade mänskliga ö-celler (HIP-ö-celler). En vuxen deltagare inkluderades.
Donator och tillverkning
Ö-celler isolerades från en blodgrupps-O-matchad avliden donator. I Oslo dissocierades öarna till enskilda celler och genredigerades med Cas12b och styr-RNA för att inaktivera B2M (nödvändig för HLA klass I) och CIITA (huvudregulator för HLA klass II).
Cellerna fick återbilda ö-liknande kluster och lentiviralt transducerades (virusbaserad metod för att föra in gener) för CD47-överuttryck. Flödescytometrin visade att 85,8 % saknade HLA klass I, 100 % saknade HLA klass II och 46,4 % uttryckte höga nivåer av CD47.
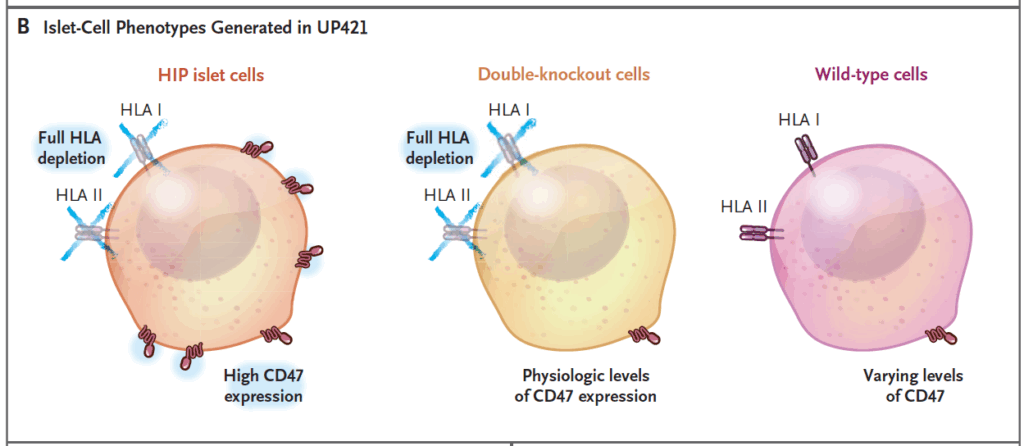
Det färdiga preparatet bestod av tre fenotyper: fullständigt HIP-celler (HLA-negativa med högt CD47), dubbel-knockoutceller med fysiologiskt CD47 och en mindre andel vildtypsceller (orörda celler som behållit HLA-uttryck) med varierande CD47. Cellerna behöll samma celltypssammansättning som utgångsmaterialet (ungefär två tredjedelar betaceller).
Transplantationen
Totalt 79,6 miljoner HIP-ö-celler injicerades i vänster brachioradialis-muskel(underarmsmuskel) via 17 stickkanaler under generell anestesi. Cellerna placerades som ett ”pärlband” längs varje kanal. Patienten fick ingen glukokortikoid, antiinflammatorisk eller immunhämmande behandling. Övernattningsvård gavs för observation.
Uppföljning och analyser
Under 12 veckor mättes immunologisk reaktivitet mot de tre cellsubpopulationerna med flera metode för att mäta aktivitet av inflammatoriska celler såsom interferon-γ, T-celler, NK-celler, makrofager, IgM/IgG, komplementberoende ämnen, CDC och antikroppar.
Graftfunktion bedömdes med C-peptid (markör för endogen insulinsekretion) i vila över tid, samt med bilddiagnostik (MRI och PET-MRI med GLP-1-receptor-spårämne som ansamlas i betaceller). Glykerat hemoglobin (HbA1c) följdes. För att skydda det nytransplanterade graftet höjdes initialt den exogena insulindosen för att undvika hyperglykemitoppar.
Resultat
Deltagare
Patienten var 42 år med 37 års typ 1-diabetes, HbA1c 10,9 % (96 mmol/mol), helt omätbar C-peptid vid screening och förekomst av GAD- och IA-2-autoantikroppar (markörer för autoimmun etiologi). Basal insulindos var 32 E/dygn.
Immunologisk reaktivitet
Analysflödet skilde konsekvent mellan svar mot vildtypsceller, dubbel-knockoutceller och HIP-celler.
T-cellssvar. Stark T-cellsaktivering (ELISpot) och T-cellsmedierad cytotoxicitet sågs endast mot vildtypsceller, med topp kring dag 7. Varken dubbel-knockout eller HIP-celler gav T-cellsaktivering eller död. Detta visar att HLA-uttryck är nödvändigt för att T-celler ska känna igen och angripa ö-cellerna.
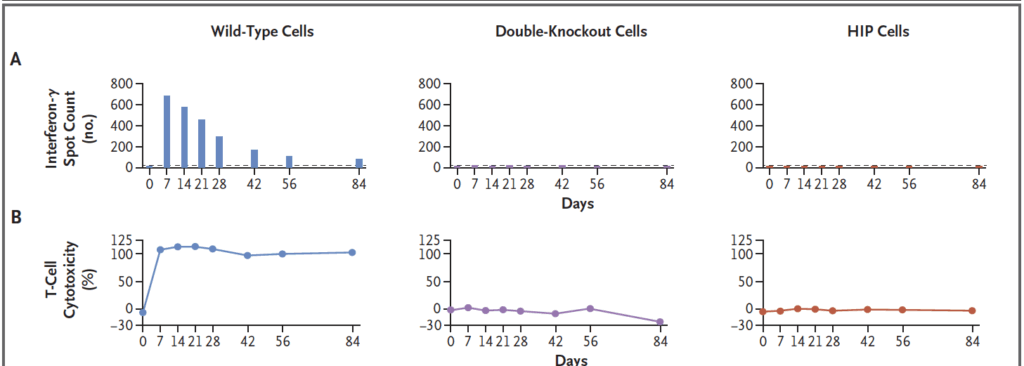
Medfödda svar. NK-celler och makrofager dödade endast dubbel-knockoutcellerna (HLA-negativa utan extra CD47). Det stämmer med mekanismen missing-self där avsaknad av HLA triggar NK-avdödning. HIP-cellerna, som är HLA-negativa men har högt CD47, överlevde i dessa tester. Vildtypsceller (med HLA) skonades av NK/makrofagerna men dödades av T-celler.
Antikroppar och effektorfunktioner. Antikroppar (IgM tidigt, sedan IgG) bildades endast mot vildtypsceller. Mot dessa sågs även CDC och ADCC med NK-celler; varken dubbel-knockout eller HIP-celler gav upphov till mätbara antikroppar eller antikroppsmedierad avdödning. I den sammanlagda PBMC+serum-assayen dödades vildtyp- och dubbel-knockoutceller men HIP-cellerna överlevde. Sammantaget dokumenterades alltså ingen detekterbar immunreaktion mot HIP-cellerna under 12 veckor trots att patienten samtidigt utvecklade robusta svar mot de andra två celltyperna.
Graftets funktion och kvarstående
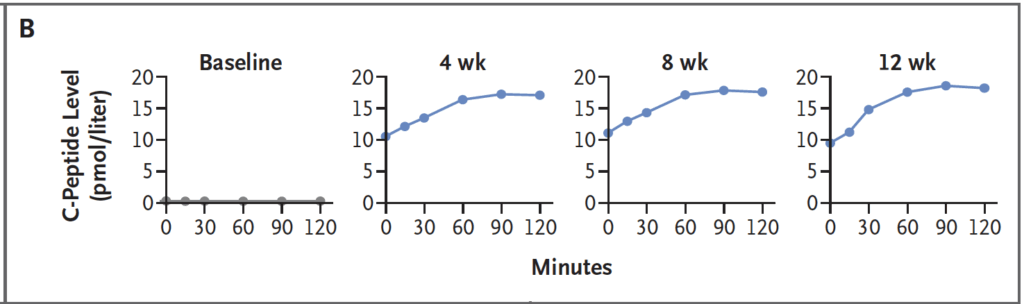
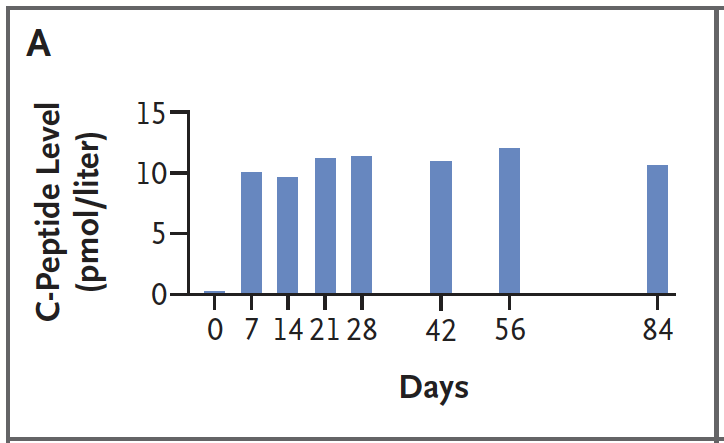
C-peptid i vila var stabil kring eller över 10 pmol/L från dag 7 till vecka 12, vilket tyder på kvarvarande och fungerande betaceller i transplantatet. Vid mixed-meal-test före transplantation var C-peptiden noll; vid 4, 8 och 12 veckor ökade C-peptid tydligt efter måltidsdrycken, vilket visar glukossvarig insulinsekretion från de transplanterade cellerna.
För att skydda graftet höjdes insulindoserna initialt; HbA1c sjönk med cirka 42 % under 12 veckor, sannolikt huvudsakligen som effekt av det höjda exogena insulinet snarare än av transplantatet, givet den låga cellmassan. MRI vid 4 och 8 veckor visade punktformiga signaler vid injektionsställena utan tecken till inflammation.
Vid 12 veckor visade PET-MRI med GLP-1R-spårämne tydlig upptagssignal i transplantatområdena, separerbar från omgivande muskulatur, vilket talar för vaskulariserade och funktionella betaceller i muskeln.
Biverkningar
Fyra biverkningshändelser inträffade, ingen allvarlig och ingen relaterad till studieläkemedlet. Patienten fick ytlig tromboflebit vid PVK-ställe och parestesier i vänster underarm, sannolikt kopplat till ingreppet. Patienten mådde i övrigt väl vid 12 veckor.
Diskussion
Detta en-patientsfall visar att genredigerade, allogena HIP-ö-celler kan överleva och fungera i människa utan immunhämmande läkemedel. Immunologiskt framträder ett tydligt ”dubbelt skydd”: genom HLA-borttagningundviks T-cellsigenkänning, och genom CD47-överuttryck blockeras NK-cellers och makrofagers angrepp på HLA-negativa celler. I patientens blod uppstod robusta, tidsmässigt typiska T-cells- och antikroppssvar mot vildtypscellerna, samt medfödd avdödning av dubbel-knockoutcellerna, medan HIP-cellerna inte triggade några mätbara svar. Detta överensstämmer med tidigare prekliniska fynd hos humaniserade möss och icke-mänskliga primater och stärker den biologiska principen.
Funktionellt gav transplantatet stabila C-peptidnivåer och måltidssvar under tre månader trots att cellmassan var låg(cirka 7,1 % av den dos som brukar krävas för insulinoberoende i klassiska ö-cellstransplantationer).
Detta talar för att en full dos HIP-celler (ungefär 18 miljoner per kg) kan räcka till insulinoberoende eller åtminstone betydande insulinreduktion, förutsatt att samma immunologiska skydd består över tid.
Bilddiagnostiken bakom GLP-1R-PETstödjer att skelettmuskulatur (här brachioradialis) är en viabel engraftment-plats – i linje med tidigare data – med tydlig tracerupptagning och utan tecken till inflammation.
Begränsningar måste samtidigt understrykas. Detta är ett enskilt fall med 12 veckors uppföljning; långtidsöverlevnad och -funktion är ännu okänd. Produkten UP421 innehöll en mindre andel HLA-positiva vildtypsceller, vilket kan sensitisera (inducera donatorspecifika HLA-antikroppar) vid upprepade transplantat, även om de vildtypsceller som fanns här snabbt eliminerades och risken därför kan vara begränsad.
Den kraftiga HbA1c-förbättringen förklaras troligen mest av ökad exogen insulindos i den tidiga fasen; effekten av transplantatet på glukoskontroll i vardagen blir tydlig först när större cellmassor används och insulin gradvis kan minskas. Säkerhet vid genterapi är en central fråga; här används lentiviral transduktion och CRISPR-Cas.
Klinisk betydelse
Om resultaten står sig i större material kan detta bli ett paradigmskifte: allogena cellterapier utan immunhämning vid typ 1-diabetes. I stället för att försöka lära immunsystemet tolerans kan man göra cellerna ”osynliga”. Det skulle öppna för upprepade transplantationer till mål-C-peptid och ge flexibilitet i dosering.
Slutsatser
I ett först-i-människa-fall överlevde och fungerade genredigerade, hypoimmuna allogena betaceller transplanterade till underarmsmuskel utan immunhämmande läkemedel. Patienten utvecklade inga detekterbara immunreaktioner mot HIP-cellerna, medan vildtypsceller och HLA-negativa celler utan CD47 överuttryck väckte förväntade immunsvar och dödades i funktionella tester. C-peptid var stabil med måltidsrespons, och bilddiagnostik visade graftpersistensutan inflammation. Biverkningarna var få och lindriga. Resultatet stödjer vidare prövning av HIP-plattformen i större och längre studier som kan utvärdera insulinminskning/oberoende, långtidssäkerhet och dos-/plats-optimering.