SGLT2-hämmare vid kronisk njursjukdom: Empagliflozin (Jardiance) och Dapagliflozin (Forxiga)
Introduktion till kronisk njursjukdom (CKD)
Kronisk njursjukdom (chronic kidney disease, CKD) definieras som en bestående njurskada där eGFR är lägre än 60 ml/min/1,73 m² under minst tre månader, vilket fastställs genom två eller fler mätningar. I Sverige uppskattas att omkring tio procent av befolkningen lever med kronisk njursjukdom.
Åldersrelaterade förändringar i njurarna är vanliga. Många individer uppvisar en lätt förhöjning av S-kreatinin och en sänkt eGFR, särskilt personer med kardiovaskulära riskfaktorer såsom högt blodtryck, diabetes och förhöjda blodfetter.
När nedsatt glomerulär filtrationshastighet (eGFR) kombineras med albuminuri utgör detta däremot en uttalad och oberoende riskfaktor för kardiovaskulära händelser, en progressiv försämring av njurfunktionen och en ökad risk för akut njursvikt.
Tabell 1: Diagnostik och klassificering av kronisk njursjukdom (CKD) baserat på s-kreatinin, eGFR och albuminuri
| Prov | Diagnostiska kriterier | Klassificering |
|---|---|---|
| S-kreatinin | Höga nivåer indikerar nedsatt njurfunktion. Måste bekräftas över ≥3 månader. | Används för att beräkna eGFR (ej direkt klassificering). |
| eGFR | CKD definieras vid eGFR <60 ml/min/1,73 m² i ≥3 månader. | Steg G1-G5: – G1: eGFR ≥90 – G2: 60–89 – G3a: 45–59 – G3b: 30–44 – G4: 15–29 – G5: <15 |
| Albuminuri | Uppmätt via urin-albumin/kreatinin-kvot (UACR): – CKD vid UACR ≥30 mg/g i ≥3 månader. | Kategori A1-A3: – A1: <30 mg/g – A2: 30–300 mg/g – A3: >300 mg/g |
Tabell 2: Klassificering av CKD baserat på ålder och kön
| Parameter | Normvärden/Anpassning | Klinisk tolkning |
|---|---|---|
| s-Kreatinin | – Män: 60–105 µmol/L – Kvinnor: 45–90 µmol/L – Ökar med ålder och muskelmassa. | Högre s-kreatinin hos äldre eller muskulösa kan ge falskt låg eGFR. |
| eGFR | – Unga vuxna: Normalt >90 ml/min/1,73 m² – eGFR minskar med ≈1 ml/min/år efter 40. | eGFR <60 hos unga är alltid patologiskt. Hos äldre kan lågt eGFR vara åldersrelaterat. |
| Albuminuri | Ingen åldersanpassning, men UACR kan vara högre vid hypertoni eller diabetes. | A3 (UACR >300 mg/g) indikerar hög risk för progression, oavsett ålder. |
Behandling vid kronisk njursjukdom
1. Antihypertensiv behandling
- Samtliga patienter skall erbjudas RAAS blockad, dvs antingen ACE-hämmare eller ARB – ex Ramipril, Enalapril, Captopril, Candesartan, Losartan och Valsartan
- Kalciumantagonist – ex Felodipin, Amlodipin
- Thiazider (har en sämre effekt vid eGFR < 30 ml/min/1,73m2) – ex hydroklortiazid
- Mineralkortikoidreceptorer (MRA) – ex Eplerenon, Spironolakton, Finerenon. Skall erbjudas om eGFR >25ml/min/1,73m2 och normalt p-kalium och U-albumin/kreatinin >3g/mol samt otillräcklig blodtryckskontroll.
Efter insättning av ACE-hämmare eller ARB sjunker oftast eGFR
- Reduktion av eGFR < 15 %: acceptabelt.
- Reduktion av eGFR > 15 %: halvera dosen ACE-hämmare/ARB. Kontrollera om kreatinin och kalium inom 1 vecka eller diskutera med njurläkare.
- Om kalium > 5,5: halvera dosen ACE-hämmare/ARB eller avbryt behandlingen
2. Övrig kardiovaskulär riskfaktorkontroll
- Påbörja lipidsänkandebehandling hos individer med kronisk njursjukdom eftersom de löper ökad risk att drabbas av kardiovaskulära händelser, ex Rosuvastatin, Atorvastatin, Ezetimib eller PCSK9-hämmare
- Påbörja behandling mot högt blodsocker om individer lider av diabetes. DPP4-hämmare kan kombineras med metformin och användas i reducerad styrka ner till eGFR <15 ml/min/1,73 m2
3. SGLT2 – en hörnsten i behandlingen vid CKD
SGLT2-hämmare utgör numera en av de viktigaste behandlingarna för att bromsa försämringen av njurfunktionen hos individer med kronisk njursjukdom, oavsett om de har diabetes eller inte.
Trots detta är det många läkare, oavsett specialitet, som ännu inte känner till den mycket positiva effekt som SGLT2-hämmare har på njurarna och att dessa läkemedel bör introduceras tidigt i behandlingen.
SGLT2–hämmare och njurskydd – biologiska mekanismer
SGLT2-hämmare, såsom Jardiance och Forxiga, skyddar njurfunktionen genom flera samverkande mekanismer, både på systemisk nivå och direkt i njurvävnaden. Nedan följer en översikt ur ett biologiskt perspektiv över de effekter som ses vid behandling SGLT2-hämmare.
1. Minskat intraglomerulärt tryck
- Mekanism: SGLT2-hämmare blockerar glukos- och natriumåterupptag i proximala tubuli, vilket ökar natriures och aktiverar tubuloglomerulär feedback.
- Effekt: Afferenta arteriolen konstrigeras, vilket sänker det glomerulära filtreringstrycket. Detta minskar hyperfiltrering och glomerulär skada, särskilt vid diabetes.
2. Metabolisk omställning
- Glukos- och lipideffekter:
- Minskat glukosåterupptag leder till lägre glykemisk belastning i njurceller, vilket reducerar glykotoxicitet och oxidativ stress.
- Ökat fettförbrukning och ketonproduktion ger en mer effektiv energikälla för tubulära celler, vilket skyddar mot ischemi.
3. Antiinflammatorisk och antifibrotisk effekt
- Inflammation: SGLT2-hämmare hämmar inflammatoriska signalvägar (t.ex. NF-κB, TNF-α), vilket minskar infiltration av makrofager och cytokinproduktion.
- Fibros: Minskar aktivering av TGF-β och kollagenupplagring i interstitiet, vilket bromsar tubulointerstitiell skleros.
4. Osmotisk diures och blodtryckssänkning
- Volymreglering: Glukosuri och natriures leder till lätt volymminskning, vilket sänker systemiskt blodtryck och albuminuri.
- Effekt på albuminuri: Lägre hydrostatiskt tryck i glomeruli skyddar podocyters integritet.
Hur SGLT2-hämmare skyddar specifika njurstrukturer?
| Njurstruktur | SGLT2-hämmarens effekt |
|---|---|
| Glomeruli | Minskat kapillärtryck → färre skleroserade glomeruli. |
| Proximala tubuli | Minskat ATP-behov (mindre natriumtransport) → skydd mot hypoxi och mitokondriell dysfunktion. |
| Interstitium | Minskat inflammations- och fibrosprocesser → bevarad vävnadsarkitektur. |
| Blodkärl | Förbättrad endotelfunktion → bättre mikrocirkulation. |
EMPA-KIDNEY (Empagliflozin vid CKD)
Sammanfattning av den kliniska studien EMPA-KIDNEY
| Kategori | Information |
|---|---|
| Studiedesign | Multinationell, randomiserad, dubbelblind, placebokontrollerad studie. Totalt 6 609 deltagare från 8 länder i Europa, Nordamerika och Östasien. |
| Inklusionskriterier | – eGFR ≥20 till <45 ml/min/1,73 m², eller – eGFR ≥45 till <90 ml/min/1,73 m² med uACR ≥200 mg/g. Patienter med eller utan typ 2-diabetes inkluderades. |
| Demografi (vid baslinje) | – Medelålder: 63,8 år – Kvinnor: 33 % – Ingen tidigare diabetes: 54 % – Medel-eGFR: 37,5 ml/min/1,73 m² – Median uACR: 412 mg/g (interkvartilintervall: 94–1190 mg/g) – uACR <300 mg/g: 48 % av deltagarna. |
| Primärt utfallsmått | Sammanvägt utfall av: – Försämring av njurfunktion (≥40 % minskning av eGFR, ESKD eller död i njursjukdom), eller – Död i kardiovaskulär orsak. |
| Sekundära utfallsmått | – Endast njurrelaterade händelser (≥40 % minskning av eGFR, ESKD eller död i njursjukdom) – Endast ESKD – Kardiovaskulär död – Total dödlighet – Sjukhusinläggning av alla orsaker. |
| Resultat (primärt utfall) | – Empagliflozin: 13,1 % (432 av 3 304 deltagare) – Placebo: 16,9 % (558 av 3 305 deltagare) – Hazard ratio (HR): 0,72 (95 % konfidensintervall [KI]: 0,64–0,82; P < 0,001). |
| Resultat (sekundära utfall) | – Endast njurrelaterade händelser: HR 0,79 (95 % KI: 0,72–0,87) – ESKD: HR 0,74 (95 % KI: 0,64–0,87) – Kardiovaskulär död: HR 0,75 (95 % KI: 0,59–0,95) – Total dödlighet: HR 0,86 (95 % KI: 0,74–1,01) – Sjukhusinläggning av alla orsaker: HR 0,86 (95 % KI: 0,78–0,95). |
| Slutsats | Empagliflozin minskade signifikant risken för progression av njursjukdom och kardiovaskulär död hos patienter med CKD, oavsett förekomst av diabetes. Effekten var konsekvent över olika subgrupper och toleransen för behandlingen var god. |
Inklusionskriterier
Deltagarna i EMPA-KIDNEY hade kronisk njursjukdom (CKD) med en beräknad glomerulär filtrationshastighet (eGFR) mellan 20–45 ml/min/1,73 m², eller en eGFR mellan 45–90 ml/min/1,73 m² med en urinalbumin-kreatininkvot (UACR) ≥200 mg/g.
Patienter med eller utan diabetes typ 2 inkluderades, men de fick inte ha hjärtsvikt eller proteinuri orsakad av andra tillstånd än diabetisk eller hypertoni-relaterad njursjukdom.
Behandlingsalternativ
Patienter randomiserades till att få antingen empagliflozin (10 mg dagligen), en SGLT2-hämmare, eller placebo, utöver standardbehandling enligt riktlinjer (t.ex. RAAS-hämmare).
Baselinekomorbiditeter och variabler
- Komorbiditeter: Cirka 50% hade diabetes typ 2, och en stor del hade hypertoni (≈85%). Andra vanliga komorbiditeter inkluderade kardiovaskulär sjukdom (≈25%).
- Baselinevariabler: MedeleGFR var ≈35 ml/min/1,73 m², median-UACR var ≈900 mg/g. Medianålder var 64 år, och ≈33% var kvinnor.
Primärt utfallsmått
Progression av njursjukdom (definierad som terminal njursvikt, signifikant eGFR-minskning eller njurrelaterad död) eller kardiovaskulär död.
Sekundära utfallsmått
Inkluderade hjärtsvikt-relaterade hospitalisering, allmän dödlighet och förändring av eGFR över tid.
Resultat
Empagliflozin reducerade risken för den primära slutpunkten med 28% (HR 0,72; 95% KI 0,64–0,82; p<0,001). Effekten var konsekvent oavsett diabetesstatus eller UACR-nivå. Sekundära slutpunkter visade också fördelar, inklusive 14% riskminskning för kardiovaskulär död eller hjärtsvikt (HR 0,86).
Tolkning
Resultaten bekräftar att empagliflozin skyddar mot njursjukdomsprogression och kardiovaskulära händelser hos patienter med CKD, även utan diabetes eller hög albuminuri. Detta stöder användningen av SGLT2-hämmare som en bred behandlingsstrategi för CKD.
Jämförelse med andra SGLT2-studier i CKD
- DAPA-CKD (dapagliflozin): Visade liknande effekt (HR 0,61 för njurrelaterad slutpunkt) men inkluderade endast patienter med UACR ≥200 mg/g.
- CREDENCE (canagliflozin): Fokuserade på diabetespatienter med CKD och UACR >300 mg/g, med 30% riskminskning.
EMPA-KIDNEY utmärker sig genom att inkludera en bredare CKD-population, inklusive icke-diabetiker och patienter med lägre albuminuri. Detta indikerar att SGLT2-hämmare kan vara effektiva även vid mildare njurskador, vilket utökar den potentiella patientgruppen jämfört med tidigare studier.
Klinisk implikation
EMPA-KIDNEY stärker evidensen för att SGLT2-hämmare bör vara en standardbehandling vid CKD, oberoende av diabetesstatus. Resultaten understryker vikten av tidig intervention för att bromsa njurskada och förbättra kardiovaskulära utfall.
Jardiance och effekt på kompoeitutfall (försämrad njurfunktion, död i kardiovaskulär händelse eller njursjukdom)
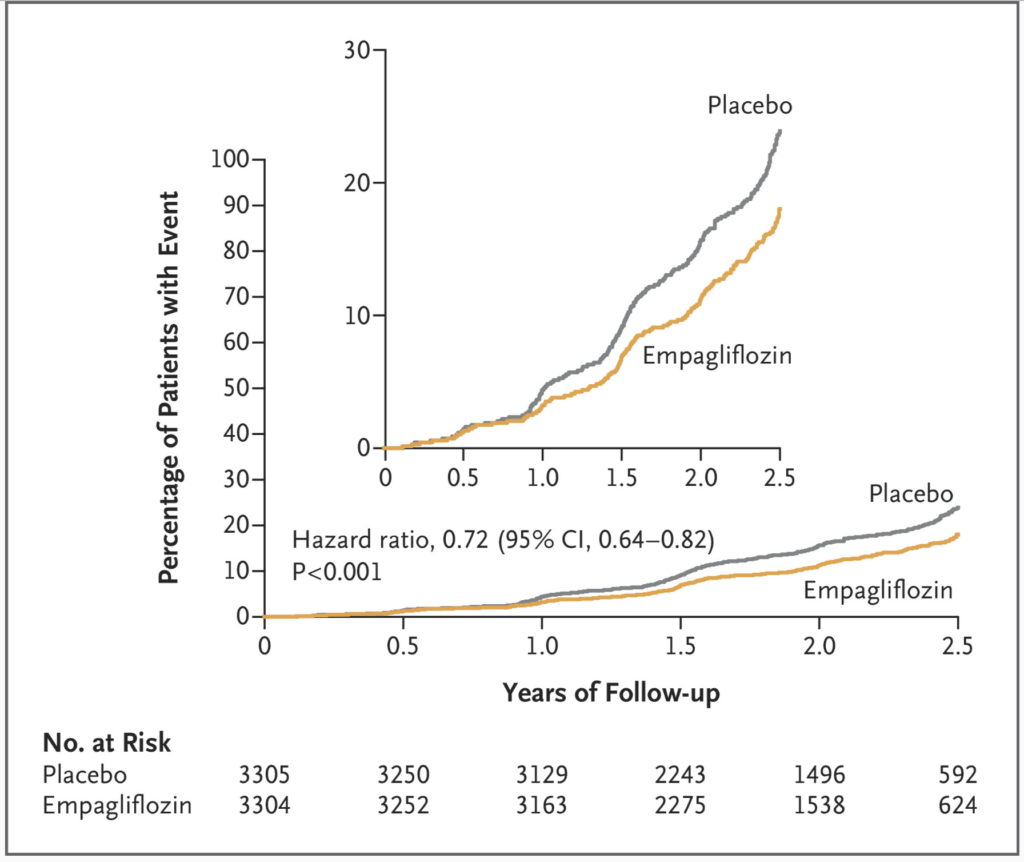
Effekt på primärt- och sekundärt utfallsmått
| Outcome | Empagliflozin (N=3304) | Placebo (N=3305) | Hazard Ratio (95% CI)* | P Value | ||
|---|---|---|---|---|---|---|
| no. (%) | no. of events/100 patient-yr | no. (%) | no. of events/100 patient-yr | |||
| Primary outcome: progression of kidney disease or death from cardiovascular causes | 432 (13.1) | 6.85 | 558 (16.9) | 8.96 | 0.72 (0.64–0.82) | <0.001 |
| Hospitalization for heart failure or death from cardiovascular causes | 131 (4.0) | 2.04 | 152 (4.6) | 2.37 | 0.84 (0.67–1.07) | 0.15 |
Effekten av Jardiance på eGFR
Båda grupperna uppvisade en minskning av eGFR över tid, vilket är förväntat hos personer med njursjukdom. Gruppen som behandlades med empagliflozin hade dock en långsammare nedgång i eGFR jämfört med placebogruppen, särskilt efter de första månaderna.
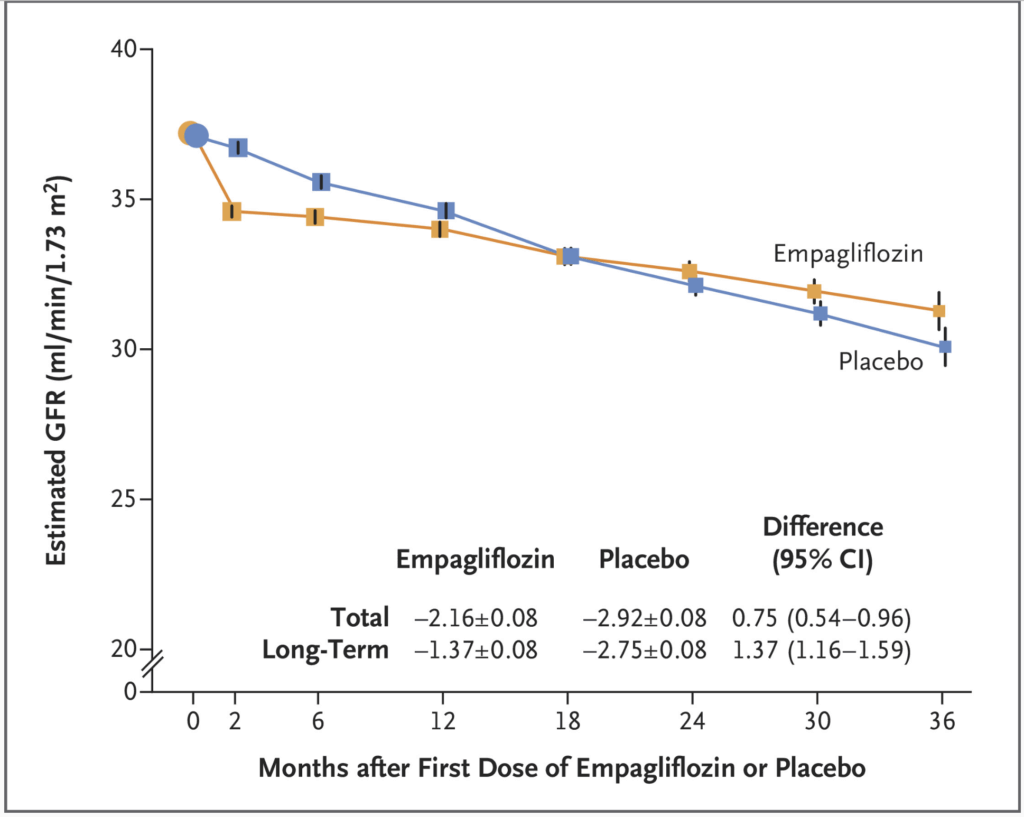
Den totala minskningen av eGFR var:
- Empagliflozin: –2,16 ± 0,08 ml/min/år
- Placebo: –2,92 ± 0,08 ml/min/år
- Skillnad: 0,75 ml/min/år till fördel för empagliflozin (95 % konfidensintervall: 0,54–0,96)
Vid långsiktig uppföljning, efter den initiala “dippen”, var försämringen:
- Empagliflozin: –1,37 ± 0,08 ml/min/år
- Placebo: –2,75 ± 0,08 ml/min/år
- Skillnad: 1,37 ml/min/år till fördel för empagliflozin (95 % konfidensintervall: 1,16–1,59)
DAPA–CKD (Dapagliflozin, Forxiga)
Sammanfattning av DAPA-CKD-studien
| Kategori | Information |
|---|---|
| Studiedesign | Multicenter, randomiserad, dubbelblind, placebokontrollerad studie. 4 304 deltagare randomiserades till dapagliflozin (10 mg/dag) eller placebo + standardbehandling. Uppföljning: median 2,4 år. Avbröts tidigt p.g.a. tydlig effekt. |
| Inklusionskriterier | – Vuxna med CKD (eGFR 25–75 ml/min/1,73m²; UACR 200–5000 mg/g). – Stabil dos av ACE-hämmare/ARB om inte kontraindicerat. – Inkluderade både patienter med och utan typ 2-diabetes. |
| Demografi vid baslinje | – Medelålder: 62 år. – 67 % män, 33 % kvinnor. – 33 % hade typ 2-diabetes. – Medel-eGFR: 43 ml/min/1,73m²; median-UACR: 950 mg/g. |
| Primärt utfallsmått | Sammansatt mått: Varaktig ≥50 % nedgång i eGFR, ESKD (dialys/transplantation), njursrelaterad död eller kardiovaskulär död. |
| Sekundära utfallsmått | – Delkomponenter av primärt utfall. – Allmän dödlighet. – Kardiovaskulär död/hospitalisering för hjärtsvikt. – Försämrad njurfunktion (eGFR-sluttakt). |
| Resultat | – Primärt utfall: Riskminskning 39 % (HR 0,61; 95 % CI 0,51–0,72). – Allmän dödlighet: 31 % riskminskning (HR 0,69; 95 % CI 0,53–0,88). – Säkerhet: Liknande biverkningsprofil som placebo (t.ex. volymbrist men sällsynt ketoacidos). |
| Slutsats | Dapagliflozin minskar risken för njursvikt, kardiovaskulär död och allmän dödlighet hos CKD-patienter med och utan diabetes. Rekommenderas som tillägg till standardbehandling för att bromsa CKD-progression. |
Studiedesign och metodik
DAPA-CKD-studien, en multicenter, randomiserad, dubbelblind och placebokontrollerad fas III-studie, inkluderade 4 304 patienter med kronisk njursjukdom (CKD) som randomiserades till dapagliflozin 10 mg dagligen eller placebo, utöver sedvanlig behandling.
Studien avbröts i förtid efter en medianuppföljning på 2,4 år på grund av en tydlig behandlingsfördel, vilket understryker interventionens kliniska betydelse. Studiens design möjliggjorde en rigorös utvärdering av dapagliflozins effekt på njur- och kardiovaskulära utfall i en heterogen patientpopulation.
Inklusionskriterier och population
Deltagarna var vuxna med CKD, definierad som estimerad glomerulär filtrationshastighet (eGFR) 25–75 ml/min/1,73 m² och en urin albumin-kreatinin-kvot (UACR) på 200–5000 mg/g, med stabil dos av ACE-hämmare eller angiotensin II-receptorblockerare (ARB) om detta inte var kontraindicerat.
Studien inkluderade unikt både patienter med och utan typ 2-diabetes (33 % respektive 67 %), vilket breddade applicerbarheten till en icke-diabetisk CKD-population.
Baslinjedemografi och kliniska egenskaper
Kohorten hade en medelålder på 62 år, med 67 % män och 33 % kvinnor. Medelvärdet för eGFR vid baslinjen var 43 ml/min/1,73 m² och medianvärdet för UACR 950 mg/g, vilket speglar en population med måttlig till svår njurfunktionsnedsättning.
En tredjedel av deltagarna hade samtidig typ 2 diabetes, vilket möjliggjorde analys av behandlingseffekter oberoende av diabetesstatus.
Primärt och sekundära utfallsmått
Det primära utfallet var en sammansättning av varaktig ≥50 % sänkning av eGFR, behov av njurersättningsterapi (dialys eller transplantation), njurrelaterad död eller kardiovaskulär död.
Forxiga och effekt på njurspecifika event
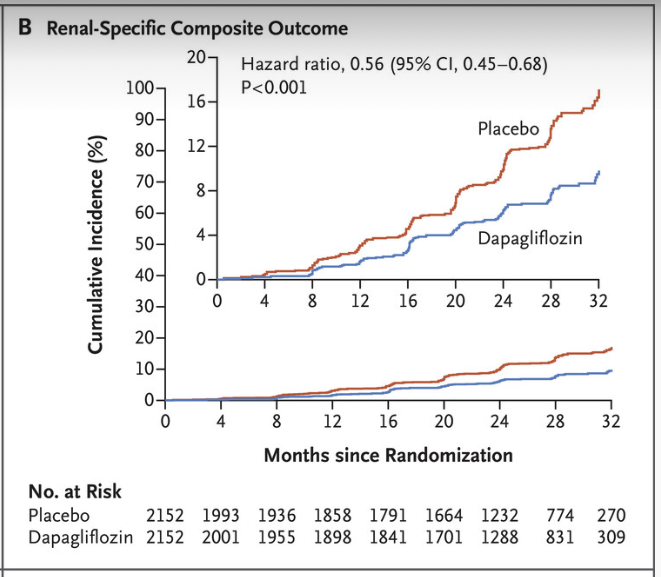
Sekundära utfall inkluderade delkomponenter av det primära utfallet, allmän dödlighet, kardiovaskulär död eller sjukhusvård för hjärtsvikt samt eGFR-försämring över tid. Dessa mätpunkter valdes för att fånga både njurspecifika och bredare kliniska konsekvenser.
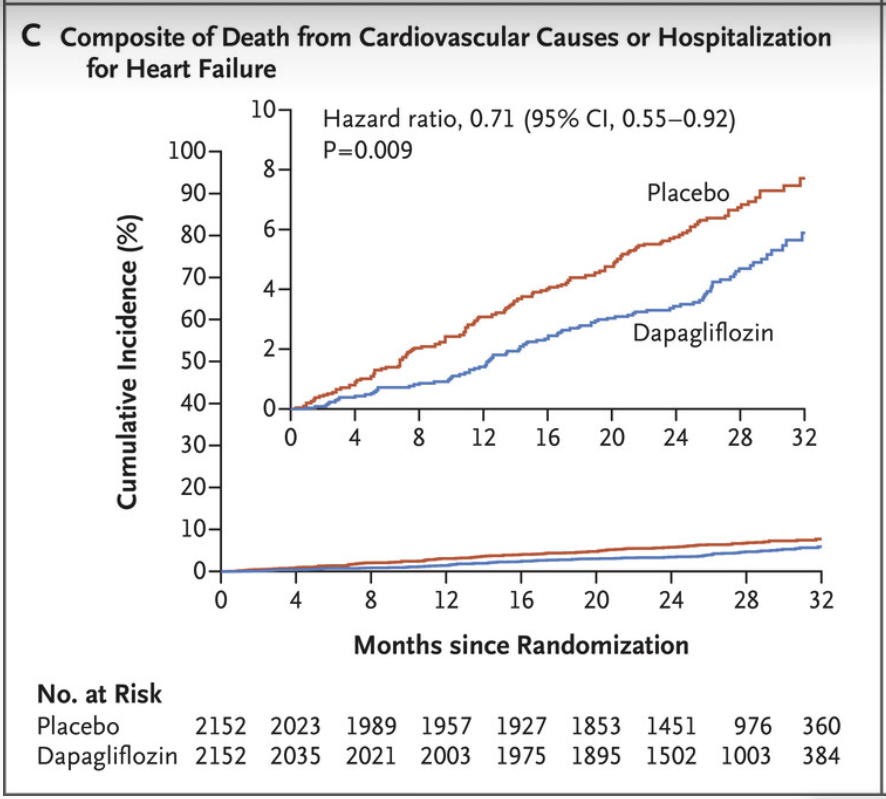
Forxiga och effekt på kardiovaskulär död och hjärtsvikt hospitalisering
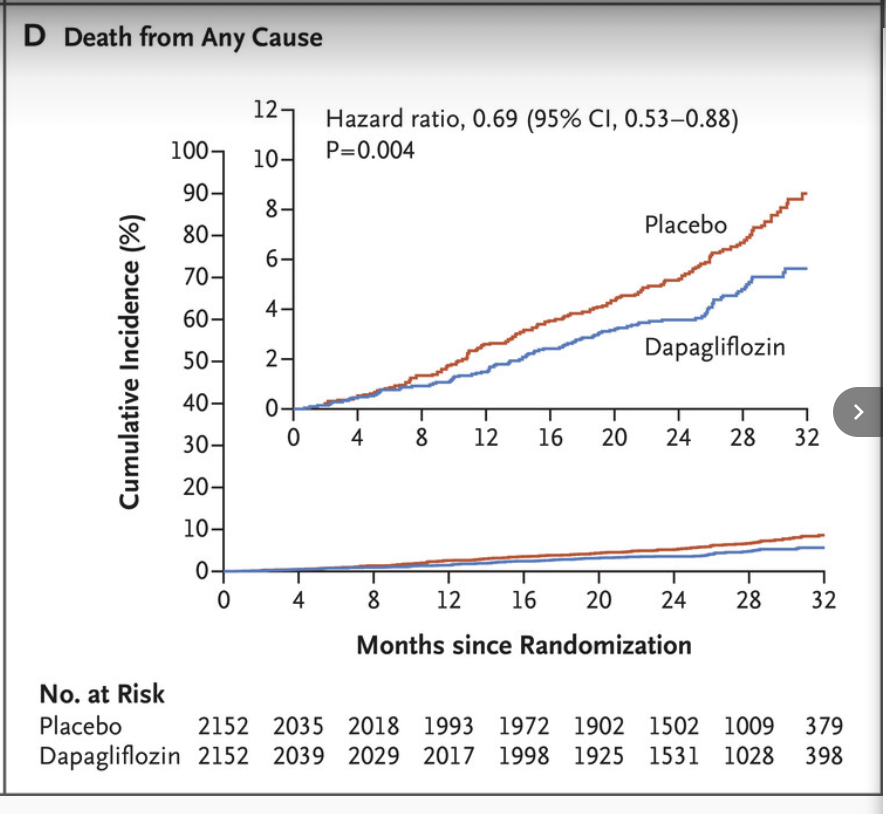
Forxiga och effekt på all dödlighet
Resultat och säkerhetsprofil
Dapagliflozin reducerade risken för det primära utfallet med 39 % (HR 0,61; 95 % KI 0,51–0,72), med konsekventa fördelar i båda diabetessubgrupperna. Den allmänna dödligheten minskade med 31 % (HR 0,69; 95 % KI 0,53–0,88), och kardiovaskulär död eller sjukhusvård för hjärtsvikt reducerades signifikant.
Säkerhetsprofilen var god, med en biverkningsförekomst liknande den vid placebo, förutom en låg frekvens av volymrelaterade biverkningar och enstaka fall av diabetisk ketoacidos.
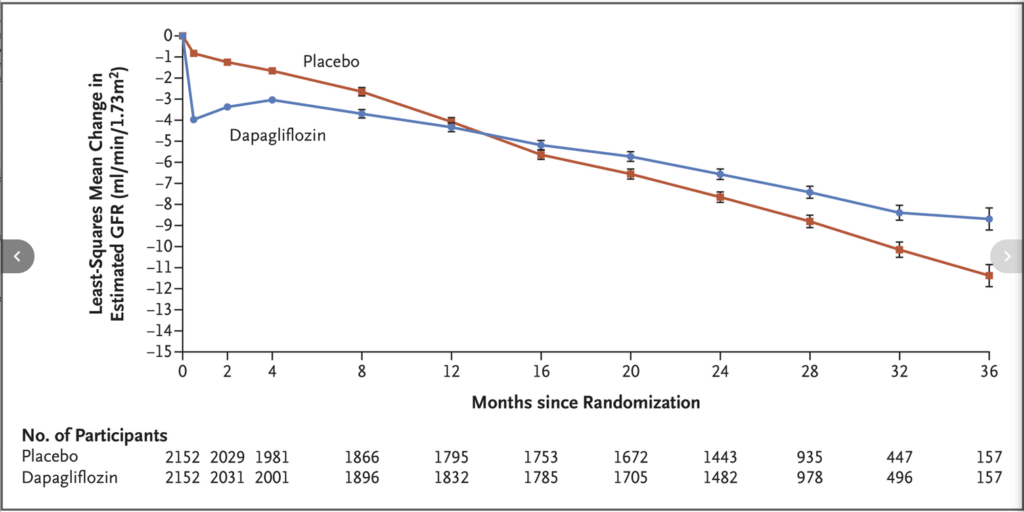
Forxiga och effekt på eGFR
Jardiance vs Forxiga – rekommendation om behandling
Evidensbaserad effekt på njurprogression
Både Forxiga och Jardiance har i randomiserade kontrollerade studier (RCT:er) visat signifikant njurskydd. DAPA-CKD-studien (N = 4 304) reducerade det primära utfallet – definierat som ≥50 % minskning av eGFR, terminal njursvikt eller njur-/kardiovaskulär död – med 39 % (HR 0,61; p < 0,001) hos patienter med kronisk njursjukdom, oavsett förekomst av diabetes.
EMPA-KIDNEY-studien (N = 6 609) visade en riskreduktion på 28 % (HR 0,72; p < 0,001) för ett liknande sammansatt utfall, men inkluderade ett bredare eGFR-intervall (t.ex. 20–45 ml/min/1,73 m² vid UACR <300 mg/g).
Forxiga effektstorlek framstår som större i populationer med uttalad proteinuri (UACR ≥200 mg/g), medan Jardiance kan vara fördelaktigt vid lägre grad av albuminuri eller vid mild till måttlig eGFR-sänkning.
Patienturval och applicerbarhet
Forxiga har starkast evidens för behandling av avancerad proteinurisk CKD (UACR ≥200 mg/g; eGFR 25–75 ml/min/1,73 m²). Jardiance, med bredare inklusionskriterier (eGFR 20–90 beroende på UACR), omfattar tidigare stadier av CKD och patienter med icke-proteinurisk njursjukdom.
För kliniker som främst behandlar patienter med diabetesdominerade tillstånd kan Jardiance dessutom erbjuda en fördel genom minskad kardiovaskulär mortalitet, baserat på resultaten från EMPA-REG OUTCOME.
Samtidigt är Forxiga data mer CKD-specifika och inkluderar även patienter utan diabetes.
Säkerhet och tolerabilitet
Båda läkemedlen uppvisar liknande säkerhetsprofiler. Det finns en ökad risk för genitala svampinfektioner (relativ risk cirka 3–5 gånger), medan allvarlig diabetisk ketoacidos är mycket sällsynt (<0,1 %).
Forxiga ges i en fast dos om 10 mg dagligen, vilket potentiellt minskar risken för biverkningar hos äldre eller sköra patienter, jämfört med Jardiance som doseras i 10–25 mg. Ingen tydlig skillnad har observerats mellan läkemedlen vad gäller volymrelaterade biverkningar. Den högre dosen kan erbjudas till individer med diabetes som har behov av ökad antihyperglykemisk behandling.
Kliniska implikationer och rekommendationer
Valet av läkemedel bör individualiseras:
Forxiga är förstahandsval vid proteinurisk CKD (UACR ≥200 mg/g), oavsett diabetesstatus, särskilt i intervallet eGFR 25–75, baserat på överlägsen effekt i denna subgrupp.
Jardiance prioriteras vid icke-proteinurisk CKD, tidigare stadier av njursjukdom (eGFR >45 ml/min/1,73 m²) eller vid samtidig kardiovaskulär risk, där läkemedlets dokumenterade effekt på hjärtsvikt är särskilt relevant.
Slutgiltigt budskap
Både Forxiga och Jardiance är effektiva behandlingar vid CKD. Forxiga har dock starkare stöd vid proteinurisk njursjukdom, medan Jardiance erbjuder större flexibilitet vid tidigare stadier, fler patientgrupper och har en bevisad effekt på kardiovaskulär död hos individer med diabetes.
Det slutliga valet bör anpassas efter patientens kliniska fenotyp och samsjuklighet för att optimera både njur- och kardiovaskulärt skydd.