Historien bakom GLP-1 för behandling av fetma – årets Lasker-DeBakey-pris
2024 Lasker-DeBakey priset för klinisk medicinsk forskning
Lasker-DeBakey Priset år 2024 för bästa kliniska medicinska forskning har tilldelats Joel Habener, MD, Svetlana Mojsov, PhD, och Lotte Bjerre Knudsen, DMSc, för upptäckten av GLP-1 (glukagonliknande peptid-1) för behandling av fetma.
Sekretin
År 1902 gjorde William Bayliss och Ernest Starling en banbrytande upptäckt inom fysiologin. De identifierade det första hormonet, sekretin, genom att studera matsmältningens processer. Deras forskning visade att sekretin produceras i tunntarmen och stimulerar bukspottkörteln (pankreas) till att utsöndra proteiner som kallas för matsmältningsenzymer.
Sedan den banbrytande upptäckten av sekretin-liknande aktivitet av Bayliss och Starling år 1902 har forskare undersökt tarmhormonernas biologi. Vi har nu förstått att systemet med enteroendokrina celler (specialiserade celler i tarmen som utsöndrar hormoner) är kroppens största endokrina system (hormonsystem).
Det bidrar med dussintals peptidhormoner (små proteiner som fungerar som signaler i kroppen) som reglerar hunger, mättnad, tarmrörelser, tarmens barriärfunktion och immunsystemet. De hjälper även till med att absorbera, smälta och ta upp energi från maten vi äter.
Det är därför passande att Lasker–DeBakey Clinical Medical Research Award för 2024 tilldelas Joel Habener, Svetlana Mojsov och Lotte Bjerre Knudsen för deras vetenskapliga insatser som möjliggjorde upptäckten och utvecklingen av GLP-1 (glukagonliknande peptid-1) receptoragonister. Dessa läkemedel har revolutionerat behandlingen av fetma och övervikt som länge saknat effektiva och säkra behandlingar, till skillnad från typ 2 diabetes (T2D).
Behandlingar för typ 2 diabetes har blomstrat sedan 1950-talet tack vare den gemensamma förståelsen av typ 2 diabetes som en sjukdom. Anledningen till att fetma, övervikt och diabetes ofta nämns tillsammans är för att fetma och övervikt är i själva verket huvudorsaken till typ 2 diabetes i majoriteten av alla åldersgrupper.

Ungefär 80-90% av alla med typ 2 diabetes har fetma eller övervikt och biologin bakom fetma är oftast ett förstadium till typ 2 diabetes och har ett direkt orsakssamband med utvecklingen av typ 2 diabetes och ett dussintals andra ålders-relaterade sjukdomar.
Joel Habener och upptäckten av glukagon
Hormonet glukagon, som produceras främst i bukspottkörtelns Langerhanska öar (grupper av hormonproducerande celler), upptäcktes 1923. Glukagon fungerar som ett motreglerande hormon till insulin, vilket betyder att det motverkar insulinets effekter och hjälper till att hålla blodsockernivåerna stabila när vi fastar.
Senare upptäcktes immunreaktiva proteiner (proteiner som kan reagera med immunförsvaret) som liknar glukagon men har en större molekylvikt, som till exempel glykentin, i blodcirkulationen och tarmen. Dessa proteiner tros komma från enteroendokrina celler i tarmen och deras upptäckt pekade på att det finns glukagonrelaterade peptider utanför bukspottkörteln.
När Habener och hans kollegor först arbetade med marulk och senare med råttor, kartlade de sekvenserna av komplementära DNA och gener som kodar för glukagon. Detta förtydligade förhållandet mellan glukagon och glykentin och ledde till upptäckten av två nya, strukturellt liknande peptider, som fick namnen GLP-1 (glukagonliknande peptid-1) och GLP-2 (glukagonliknande peptid-2).
Svetlana Mojsov – utvecklandet av GLP-1
Svetlana Mojsov är en kemist vid Massachusetts General Hospital som började studera den post-translationella bearbetningen av pro-glukagon genom att syntetisera olika hypotetiska former av GLP-1 och utveckla antikroppar och radioimmunoassays för att upptäcka glukagonliknande peptider.
När kroppen tillverkar olika proteiner så genomgår dessa proteiner oftast förändringar efter bildandet av själva proteiner inuti cellen. Dessa förändringar innebär att olika mindre strukturer binder sig till proteiner och bidrar till att proteiner utvecklar specialiserade funktioner och endast reagerar med särskilda receptorer på cellens yta.
Dessa ansträngningar avslöjade flera former av GLP-1 i bukspottkörteln och tarmen hos råttor, inklusive upptäckten att en förkortad form av GLP-1 (7–37) som var riklig i tarmextrakt. Ett viktigt fynd var att N-terminalt förkortade former av GLP-1, som GLP-1(7–37) och GLP-1(7–36), men inte GLP-1(1–37), visade insulinotrop aktivitet (förmåga att stimulera insulinfrisättning) när de testades i bukspottkörtelsystem och i Langerhanska ö-celler som fick blod (perfunderades).
Den kliniska betydelsen av dessa prekliniska studier fastställdes snabbt genom demonstrationen att GLP-1(7–36) snabbt ökade nivåerna av cirkulerande insulin och minskade glukagonnivåerna hos friska mänskliga deltagare, vilket därmed sänkte den maximala blodsockerresponsen efter att studiedeltagarn fått socker direkt i blodet genom infarter (intravenös glukosinfusion) .
Lotte Bjerre Knudsen – framtagandet av GLP-1 som läkemedel
Strävan efter läkemedel som efterliknar effekterna av naturligt GLP-1 för behandling av typ 2 diabetes möttes av utmaningar, bland annat den snabba nedbrytningen och elimineringen av naturligt GLP-1, samt att illamående, diarré och kräkningar uppstod när för mycket GLP-1 administrerades snabbt.
Anmärkningsvärt nog, efter mer än ett decennium av ansträngningar för att övervinna dessa hinder, blev ett strukturellt liknande protein från salivkörtlarna hos en ödla, exendin-4 (exenatid), år 2005 det första GLP-1-baserade läkemedlet som godkändes för typ 2 diabetes.
Även om exenatid är relativt motståndskraftigt mot enzymatisk inaktivering av dipeptidylpeptidas 4 (DPP-4), kräver det två doser per dag och ger inte den kontinuerliga, 24-timmars aktivering av GLP-1-receptorn som visats vara effektiv för att förbättra blodsockerkontrollen.
Lotte Knudsen och hennes team i Köpenhamn tog sig an att åtgärda dessa begränsningar och utvecklade liraglutid, den första humana GLP-1-analogen som var relativt DPP-4-resistent. Genom acylering (en kemisk förändring) band sig liraglutid icke-kovalent till albumin, vilket ytterligare begränsade nedbrytningen av DPP-4 och förlängde halveringstiden i blodet.
Kliniska fynd på viktminskning
Detta möjliggjorde att liraglutid blev det första långverkande GLP-1-läkemedlet som godkändes för typ 2-diabetes, med en verklig 24-timmars profil av farmakologisk aktivering av GLP-1-receptorn. Trots att måttlig viktminskning på 1 till 3 % av den ursprungliga kroppsvikten hade observerats med doser av exenatid eller liraglutid, som användes för behandling av typ 2-diabetes, var entusiasmen begränsad för att testa högre doser på grund av oro över biverkningarna.
Trots en betydande tvekan inom läkemedelsindustrin vid den tiden gällande den kommersiella livskraften för fetmabehandlingar, testade Knudsen och hennes team högre doser av liraglutid på 2,4 mg och 3 mg en gång dagligen. Detta ledde till betydligt större viktminskning hos personer med fetma än vad som observerades med 1,8 mg daglig dos hos personer med typ 2 diabetes. År 2014 blev liraglutid det första GLP-1-läkemedlet som godkändes för viktnedgång.
Fetma och övervikt
Fetma har länge ansetts vara ett tillstånd som bidrar till flera andra allvarliga sjukdomstillstånd såsom hjärt-kärlsjukdomar, njursjukdomar, leversjukdomar, cancer och demens. Det har knappt gått två decennier sedan man börjat förstå att fetma är en sjukdom för sig, trots att antalet människor med fetma ökat till epidemiska proportioner. Effektiva behandlingar för fetma har utvecklats under de senaste decenniet baserat på biologin hos molekylen glukagonliknande peptid-1 (GLP-1).
Upptäckten av GLP-1 fokuserade ursprungligen på diabetes, och idag används GLP-1-receptoragonister (GLP-1RA) som viktiga behandlingar för typ 2 diabetes.
Specifika artiklar om GLP-1 läkemedel på diabetes.nu
- Semaglutid för njursjukdomar
- Semaglutid mot fetma
- Tirzepatid
- MariTide
- Fetma och övervikt
- GLP-1 analoger som läkemedel
- Wegovy och Ozempic
- Inkretiner (hormoner från mag-tarmkanalen)
GLP-1 visar sig vara en “neurotransmittor”
Ole Madsen vid Hagedorn forskningsinstitut i Danmark använde en djurmodell för cancerforskning som producerade höga nivåer av glukagon, GLP-1 och peptid YY, och fann att dessa djur utvecklade en extrem anorexi med höga nivåer av cirkulerande GLP-1. GLP-1 och peptid YY tillhör en grupp hormoner som kallas för inkretiner.
Stephen Bloom vid Hammersmith Hospital i Storbritannien injicerade GLP-1 direkt i hjärnan på fastande råttor och observerade en kraftig minskning av födointaget, därefter kallade Stephen GLP-1 för en neurotransmittor, vilket innebär att ämnet även har en effekt på hjärnan.
Svår utmaning att tillverka en stabil molekyl
GLP-1 (glukagonliknande peptid-1) produceras främst av L-celler i tunntarmens sista partier, särskilt i delar av tunntarmen som kallas för ileum men även tjocktarmen (kolon). Molekylen produceras framför allt efter att man har ätit och frisätts till blodcirkulationen.
GLP-1 kan också tillverkas i mindre mängder i alfa-cellerna i bukspottkörteln (pankreas). Dessutom finns det bevis för att hjärnan kan producera små mängder GLP-1, där det verkar som en neurotransmittor och reglerar aptit och energibalans.
Tyvärr är naturligt GLP-1 inte en bra läkemedelskandidat. Farmakokinetiken (hur kroppen 1. absorberar, 2. distribuerar, 3. metaboliserar och 4. utsöndrar ett läkemedel) och farmakodynamiken (hur läkemedlet påverkar kroppen, t.ex. hur det sänker blodsockret eller påverkar kroppsvikten) för GLP-1 är tydliga: för att uppnå bästa effekt på att sänka blodsockret eller kroppsvikten krävs att tillräckligt höga koncentrationer av läkemedlet i kroppen under 24 timmar om dygnet, oavsett hur ofta läkemedlet administreras.
Naturligt GLP-1 bryts dock snabbt ner och elimineras ur kroppen, vilket ger en mycket kort halveringstid (den tid det tar för läkemedlets koncentration att halveras i kroppen). Dessutom är molekylen svår att formulera (att skapa ett stabilt och användbart läkemedel). Långverkande formuleringar av GLP-1 eller enkla analoger (kemiska varianter) av GLP-1 testades i kliniska prövningar men misslyckades på grund av hudreaktioner. En annan lösning behövdes.
Det första långverkande GLP-1 läkemedlet
Det första långverkande GLP-1RA (GLP-1-receptoragonisten, ett läkemedel som binder till GLP-1-receptorer och aktiverar dem) var liraglutid, en fettförsyrad (fettsyra som är bunden till molekylen) analog av GLP-1 med 97 % likhet med naturligt GLP-1.
Den forskare som ledde utvecklingen av detta läkemedlet är dessutom en av de två kvinnliga forskarna som vann årets Lasker-DeBakey pris, Lotte Bjerre Knudsen från Danmark. Hon ledde detta arbete på Novo Nordisk tillsammans med Per Franklin Nielsen och Per Olaf Huusfeldt, och föreslog att liraglutid skulle gå vidare till klinisk utveckling för behandling av fetma samt typ 2 diabetes.
Principen bakom designen av liraglutid använde en specifik typ av fettsyra (C16-fettsyra) som fästs vid en kort sekvens av aminosyror (aminosyra-spacer) som i sin tur är fäst till GLP-1’s proteinstruktur (peptidsekvens). Denna unika metod resulterade i att läkemedlet band till fettsyrebindningsställen på albumin (ett vanligt protein i blodet), vilket gjorde att albuminet fungerade som en läkemedelsreservoar.
Det formulerade läkemedlet var mycket effektivt och kunde administreras under huden med en enkel injektionsanordning för daglig användning. Liraglutid var det första läkemedlet som använde denna teknologi och som gav farmakologiska koncentrationer i kroppen 24 timmar om dygnet.
Sedan dess har teknologin utvecklats, med flera separata uppfinningar. Liraglutid blev den första långverkande GLP-1RA: godkänd för behandling av typ 2 diabetes, baserad på den mänskliga sekvensen av GLP-1, godkänd för behandling av fetma, och visade även kardiovaskulära fördelar hos personer med typ 2 diabetes.
LEADER (en klinisk prövning med Liraglutid)
Den första kliniska prövningen med Liraglutid undersökte effekten av läkemedlet i en klinisk prövning där 9340 studiedeltagare ingick. Under nästa 4 års tid följdes patienterna där ca 4700 individer ingick i en grupp som fick aktiv behandling medan övriga delen fick placebo.

Studien visade att de som fick behandling med Liraglutid hade 13% lägre risk för kardiovaskulär händelser, 22% lägre risk för kardiovaskulär död och 15% lägre risk för all dödlighet. Risken för dödlig och icke-dödlig hjärtinfarkt, stroke eller hjärtsvikt var däremot lika stor inom både behandlingsgrupper. Den vanligaste biverkan vara sådana som utvecklades i mag-tarmkanalen.
Liraglutid godkändes för behandling av typ 2 diabetes i Europea 2008 och USA 2010. Många läkemedelsföretag övergav utvecklingen av läkemedel mot fetma förutom Novo Nordisk och Eli Lilly. Novo Nordisk drev ett ambitiöst program för dessa läkemedel och fick godkännande av amerikanska läkemedelsverket (FDA) år 2014 för behandling av fetma.
GLP-1 påverkar mättnadskänsla, hunger och aptit
GLP-1 behöver inte passera blod-hjärnbarriären, eftersom GLP-1-receptorer finns uttryckta i flera circumventrikulära organ och på platser i hypotalamus där åtkomst kan ske genom fenestrerade kapillärer. Det visades att liraglutid aktiverar POMC/CART-neuroner och hämmar NPY/AgRP-neuroner, vilket påverkar några av de mest välkarakteriserade och fundamentalt viktiga neuronerna i den homeostatiska regleringen av ätande. Neuroner är ett medicinskt begrepp för nervceller.

GLP-1 påverkar inflammation, blodtryck, socker, vikt och fetter
GLP-1 är kortverkande i kroppen och involverat i ett brett spektrum av anpassningar efter måltider. Förutom att reglera glukos- och energibalansen har utvecklingen av GLP-1RA avslöjat många andra effekter som kan vara viktiga för hälsan. GLP-1RA påverkar inflammationsbalansen, och effektiva långverkande GLP-1RA minskar högkänsligt C-reaktivt protein med upp till 50 %.
Inflammation (C-reaktivt protein)
C-reaktivt protein (CRP) är ett väldigt vanligt blodprov inom medicin och används för att exempelvis upptäcka infektioner orsakade av virus, bakterier eller parasiter. Det finns flera medicinska tillstånd som föranleder en stegring av CRP.
Studier visar att GLP-1 även minskar andra markörer för inflammation i kroppen såsom nivåerna för interleukiner som är en stor familj av proteiner som aktiverar inflammation i kroppen. Kom ihåg att inflammation är bra vid aktiva infektioner men kronisk låggradig inflammation är ett tillstånd som påverkar kroppen negativt på sikt, därmed bör man sträva efter att dämpa inflammation.
Blodtryck
GLP-1 sänker också systoliskt blodtryck och triglycerider (en variant av blodfetter). Alla dessa effekter sker genom den vanliga GLP-1-receptorn. Många individer som använder blodtryckssänkande läkemedel och sedan GLP-1 analoger som Semaglutid eller Liraglutid kan uppleva yrsel och blodtrycksfall.
Orsaken till detta är att moderna GLP-1 analoger är minst lika effektiva som moderna blodtryckssänkande läkemedel. För att hantera biverkningar kan du behöva prata med dina läkare för att minska dosen av blodtryckssänkande läkemedel.
Det är viktigt att inte helt avsluta med blodtrycksläkemedel fastän du har ett bra blodtryck eftersom moderna blodtrycksläkemedel även blockerar andra negativa processer i kroppen, särskilt de som baseras på angiotensin-konverteringsenzym blockerare (ACE-hämmare) och angiotensin-receptor blockerare (ARB-läkemedel). Det är alltså rekommenderat att minska dosen för dessa men inte sätta ut medicinen helt och hållet.
Blodfetter
GLP-1 förmedlar sina effekter genom den mångsidiga biologin som kommer med GLP-1-receptorns uttryck i specifika celler i många av kroppens organ. Kliniska studier har dokumenterat ett brett spektrum av fördelar, från att minska risken för hjärt-kärlsjukdom och njursjukdom, till förbättrade funktionella resultat vid hjärtsvikt, artros och obstruktiv sömnapné.
Det finns flera olika blodfetter i människokroppen. Några av de vanligaste är LDL-kolesterol (low-density lipoprotein kolesterol), HDL-kolesterol (high-density lipoprotein kolesterol), ApoB lipoproteiner, sdLDL (small dense LDL-kolesterol), triglycerider, lipoprotein a (LpA).
Flera av dessa har ett direkt orsakssamband (kausalitet) för hjärt-kärlsjukdomar, stroke och njursjukdom. GLP-1 behandling har visat sig minska de “dåliga” blodfetterna minst lika effektivt som våra vanligaste blodfettssänkande mediciner såsom Atorvastatin och Rosuvastatin (statiner).
Leverförfettning, cancer och Alzheimers sjukdom
Undersökningar pågår för behandling av leverförfettning och Alzheimers sjukdom. I grunden har GLP-1 introducerat ett nytt koncept: en terapeutisk läkemedelsklass med separata effekter på flera sjukdomar. Inom medicinen finns inga andra exempel på en biologi som kan tillämpas så brett genom olika mekanismer.
Nyligen visades att semaglutid förbättrar kardiovaskulära utfall hos personer med fetma utan typ 2 diabetes, vilket tyder på en direkt effekt av semaglutid på hjärt-kärlsystemet, ett fynd som också stöds av djurstudier som dokumenterar en effekt på ateroskleros oberoende av viktminskning eller blodsockernivåer.
En relativt ny studie har visat att GLP-1 analoger även förbättrar överlevnaden för tjocktarmscancer. Teorin är att den enorma viktnedgång är dels fördelaktig för att minska risken för andra sjukdomar och biverkningar hos individer med cancer samt att man “stryper” energitillförseln till cancercellerna eftersom kroppen minskar energianvändning och intaget av energi i form av föda.
En transformation av fetma och åldersrelaterade sjukdomar
Semaglutid var det andra GLP-1 som godkändes för behandling av fetma och den första som resulterade i tvåsiffrig viktminskning. Semaglutids meduppfinnare är Jesper Lau, Thomas Kruse och Paw Bloch (Novo Nordisk).
Den som lever med fetma kanske inte omedelbart märker en förbättring i sitt välmående när deras diabetes eller kardiovaskulära och njurhälsa förbättras. Däremot märker personen förändringar i hunger och mättnadskänslor samt förbättrad fysisk funktion och förmåga att utföra dagliga aktiviteter.
Klinisk evidens visar att dessa läkemedel hjälper människor att hantera sitt energiintag genom att öka känslan av mättnad, minska hungerkänslor och sug, samt förändra de val de gör i sin kost.
Fetma är en sjukdom definierad av gener med evolutionära fördelar, men som har blivit ofördelaktiga i det moderna samhället. Genom historien har utvecklingen av effektiva mediciner för att behandla en specifik sjukdom alltid lett till ökad kunskap om både sjukdomen och medicinerna.
Läkemedel mot fetma
När statiner introducerades, var de inledningsvis förskrivna i liten skala och användningsområdet utökades när säkerheten hade fastställts. Med effektiva blodtrycks- och blodsockersänkande mediciner har det skett en motsvarande förändring mot att definiera lägre behandlingsgränser.
Tillgången till läkemedel för behandling av fetma kommer sannolikt att öka medvetenheten, tillgången och finansieringen av forskning och kan minska stigmat kring denna sjukdom. Att röra sig mot förebyggande vård och hälsobehållande när det gäller fetma, som är den underliggande orsaken till många hälsoproblem, måste vara ett mål.
Framgångsrikt tillämpad vetenskap är alltid resultatet av många människors arbete. GLP-1 håller troligen bara på att utvecklas; det finns fortfarande mycket att lära om GLP-1 i kardiovaskulära och njursjukdomar och potentiellt inom många andra områden.
Historien om GLP-1 hittills illustrerar på ett vackert sätt samspelet mellan vetenskapliga upptäckter inom akademiska fält och läkemedelsuppfinningar samt vetenskaplig och klinisk expertis inom läkemedelsindustrin.
GLP-1 med motståndskraft mot DPP-4
Många människor arbetar i industrin i åratal med olika uppgifter som var och en är avgörande för att föra läkemedel till marknaden. När det gäller fetma har många medicinska ledare arbetat outtröttligt under åren för att bidra till att acceptera fetma som en allvarlig kronisk sjukdom och för att säkerställa tillgång till evidensbaserade behandlingar.
Utvecklingen av läkemedel för viktminskning har periodvis bromsats av säkerhetsproblem, där obalanser i frekvensen av neuropsykiatriska eller kardiovaskulära händelser, eller cancer, har lett till att mediciner dragits tillbaka från marknaden.
GLP-1 har varit en katalysator för detta, men det finns fortfarande mycket arbete kvar som kräver fortsatt samarbete mellan akademin, industrin och samhället.
Med det senare införandet av Semaglutid, ett mer DPP-4-resistent och mycket effektivt GLP-1-läkemedel som lämpar sig för veckovis administration, och nyligen tirzepatid, den första GLP-1-coagonisten, är det nu möjligt att uppnå en genomsnittlig viktminskning på 15 till 20 % eller mer hos personer med fetma eller övervikt som har en eller flera viktrelaterade medicinska komplikationer.
Semaglutid
År 2023 visade sig semaglutid minska frekvensen av allvarliga negativa kardiovaskulära händelser med 20 % hos personer med en historia av aterosklerotisk kardiovaskulär sjukdom och fetma eller hos personer med övervikt och en eller flera viktrelaterade komplikationer. I separata studier visade sig semaglutid och tirzepatid markant minska symtom och associerade medicinska komplikationer hos personer med fetma och hjärtsvikt med bibehållen ejektionsfraktion (hjärtats förmåga att pumpa blod).

STEP studierna. STEP studierna är ett intensivt forskningsprogram som genomförs av Novo Nordisk för att studera effekten av Semaglutid på flera utfallsmått, bland annat diabetes, fetma, blodsocker, hjärt-kärlsjukdomar, njursjukdomar och flera andra ålders-relaterade sjukdomar. Studien ovan visar resultaten från en gammal studie om Semaglutid där man noterade en betydande viktminskning uppemot 18%.
Tirzepatid
Dessutom minskade semaglutid risken för njur- och kardiovaskulära sjukdomar hos personer med typ 2-diabetes som löpte risk för kronisk njursjukdom, och tirzepatid minskade apné-hypopné-index (en mätning av andningsuppehåll under sömn) och förbättrade sömnrelaterade resultat hos personer med obstruktiv sömnapné och fetma.

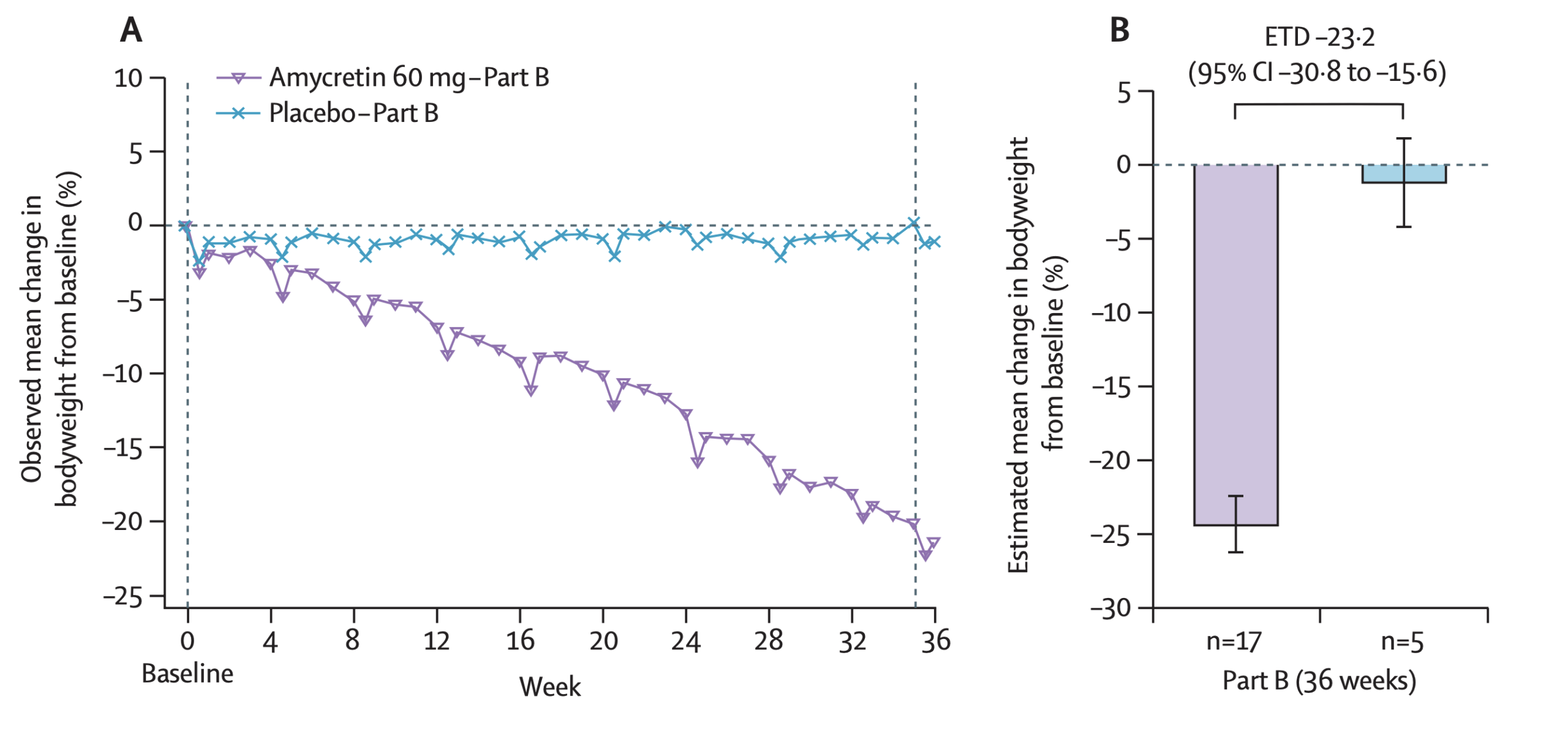
Effekten av Tirzepatid ses tydligt i Figuren ovan och Panel B. Där ses en 22.5% genomsnittlig viktminskning för individer som tog den hösta dosen av Tirzepatid. Detta motsvarar alltså många tiotals kilo av kroppsvikten som försvinner eftersom behandlingen initierades på individer som redan var överviktiga.