Läkemedel vid diabetes
Typ 2 diabetes är en kronisk metabolisk sjukdom som karaktäriseras av nedsatt känslighet för insulin (insulinresistens) och en progressiv försämring av de insulinproducerande cellernas funktion (beta-celler).
Under de senaste decennierna har en mängd olika läkemedel utvecklats för att hantera diabetes, framför allt typ 2 diabetes, med målet att förbättra blodsockerkontrollen, minska risken för komplikationer och förbättra patienternas livskvalitet.
I denna artikel kommer vi att utforska alla klasser av läkemedel som har använts för att behandla typ 2 diabetes. Artikeln beskriver hur dessa läkemedel verkar i kroppen, deras biverkningsprofil, effekten på dödlighet, vanliga hjärt-kärlsjukdomar (hjärtinfarkt, hjärtsvikt och stroke), njurpåverkan, långtidsblodsocker (HbA1c), blodtryck, blodfetter och andra kardiovaskulära riskfaktorer.
Läkemedelsgrupper vid diabetes
- Biguanider: ex, Metformin
- Sulfonureider: ex, Glipizid, Glimepirid
- DPP-4 hämmare: ex, Sitagliptin, Saxagliptin
- GLP-1: ex, Liraglutid, Exenatid, Wegovy, Ozempic
- GLP-1/GIP/GCRA: Retatrutide, Tirzepatid
- SGLT2 hämmare: ex, Jardiance, Forxiga
- Thiazolidindioner (TZD): ex, Pioglitazon
- Insulin: används vid typ 1 diabetes och även vid avancerad typ 2 diabetes
- Meglitinider: ex, Repaglinid
- Alpha-glukosidashämmare: ex, Akarbos
- Amylinanaloger: ex, Pramlintid
Den här artikeln kommer fokusera på Sulfonureider, DPP-4 hammare, GLP-1 analoger och SGLT-2 hammare eftersom dessa är de vanligaste behandlingarna vid typ 2 diabetes. Läs här för mer information om insulin vid typ 1 diabetes.
Metformin
Det första läkemedlet som diskuteras i artikeln är Metformin. Detta läkemedel tillhör en klass som heter Biguanider och representerar en central läkemedelsgrupp för behandling av typ 2 diabetes. Detta läkemedel har varit i bruk i decennier och har tidigare varit den viktigaste behandlingen vid typ 2 diabetes på grund av dess effektiva blodsockersänkande egenskaper och gynnsamma säkerhetsprofil.
Utöver användningen vid diabetes finns en hel del forskning som visar att metformin är ett läkemedel med flera okända verkningsmekanismer med flera fördelar.
Hur fungerar metformin i kroppen?
Metformin verkar främst genom att minska leverns produktion av socker (glukos). Levern är ett komplicerat organ med många funktioner, bland annat att producera och omvandla socker, en process som kallas glukoneogenes på medicinskt språk. Metformin hämmar denna process och därigenom minskar sockermängden som frisätts till blodomloppet. På så vis minskar kroppens blodsockernivåer, eftersom levern producerar mindre.
Dessutom ökar metformin insulinkänsligheten i skelettmuskler och fettvävnad, vilket förbättrar upptaget av glukos och minskar insulinresistens. Skelettmuskler och fett är några av kroppens största organ. Denna dubbla verkan gör metformin särskilt effektivt för att kontrollera blodsockernivåer hos patienter med typ 2 diabetes.
Effekten av metformin
Metformin verkar bland annat genom aktiveringen av ett protein (enzym) i kroppen som heter AMP-aktiverat proteinkinas (AMPK). Detta protein fungerar som en energisensor i kroppen celler. Det innebär att AMPK känner av energinivåerna och är delaktig i “bearbetning” av biokemisk energi.
Metformin tros också ha effekter på cellernas “kraftverk” (mitokondrier) genom att hämma det komplex som kallas för mitokondriella komplex I, vilket minskar cellens energitillgång och signalerar via AMPK att öka energianvändningen och minska energilagringen.
Kliniska effekter av metformin
Effekt på dödlighet
Flera kliniska studier har visat att metformin har en positiv effekt på dödlighet, särskilt hos patienter med övervikt eller fetma. En av de mest kända studierna, UKPDS (United Kingdom Prospective Diabetes Study), visade att patienter som behandlades med metformin hade en lägre risk för dödlighet jämfört med de som fick andra typer av glukossänkande läkemedel eller enbart livsstilsintervention.

I stora kliniska studier och meta-analyser har metformin kopplats till följande riskkvoter (HR) för olika utfall:
1. All dödlighet: I UKPDS-studien och efterföljande meta-analyser var HR för all-cause mortality cirka 0,80 (95% CI: 0,67–0,96), vilket innebär en 20% minskning av risken.
2. Kardiovaskulär sjukdom: HR för kardiovaskulära händelser var ungefär 0,79 (95% CI: 0,64–0,98), vilket tyder på en signifikant riskminskning (19%).
3. Hjärtinfarkt: HR i meta-analyser ligger runt 0,82 (95% CI: 0,70–0,97), vilket innebär en 18% minskad risk för hjärtinfarkt.
4. Stroke: HR för stroke rapporteras vanligtvis till cirka 0,90 (95% CI: 0,70–1,16), vilket indikerar en icke-signifikant minskning på 10%.
5. Njurfunktion: Metformin visar generellt en neutral till något skyddande effekt på njurfunktionen, utan betydande hazard ratios rapporterade i stora studier.
Detta beror på läkemedlets förmåga att förbättra blodsockernivåer, blodfetter och sänka blodtrycket, men också på dess direkta effekter på blodkärlen.

Effekt på njurfunktion
Metformin har generellt en skyddande effekt på njurfunktionen. Det minskar risken för progressiv njurskada genom att förbättra blodsockerkontroll och därmed minska belastningen på njurarna. Det har dock traditionellt sett funnits försiktighet vid användning av metformin hos patienter med nedsatt njurfunktion på grund av risken för laktatacidos, en sällsynt men allvarlig biverkning.
Nya riktlinjer har dock uppdaterats för att tillåta användning av metformin vid mild till måttlig nedsatt njurfunktion, med noggrann monitorering.
Effekt på HbA1c
Effekten av metformin på HbA1c har studerats i olika stora kliniska studier och meta-analyser, och resultaten visar en genomsnittlig sänkning av HbA1c på cirka 11-22 mmol/mol hos patienter med typ 2-diabetes. Effekten varierar dock beroende på patientgrupp:
1. Nydiagnostiserade patienter: Större HbA1c-sänkning, ofta runt 16-22 mmol/mol.
2. Patienter med längre sjukdomsduration: Mindre sänkning, vanligtvis runt 11-16 mmol/mol.
3. Överviktiga patienter: Generellt sett bättre svar med sänkningar upp mot 22 mmol/mol.
Metformins effektivitet är alltså mest uttalad hos nydebuterade och överviktiga patienter, medan de med långvarig diabetes kan se något mindre förbättringar.
Effekt på blodtryck
Metformin har en måttlig blodtryckssänkande effekt, främst genom att förbättra insulinkänsligheten och minska insulinresistens. Denna effekt bidrar till minskad risk för kardiovaskulära komplikationer, även om metformin inte primärt används som ett blodtryckssänkande medel.
Effekt på blodfetter
Metformin har visat sig ha en måttlig effekt på lipidprofilen, vilket kan vara gynnsamt för patienter med typ 2-diabetes. Effekterna på blodfetter inkluderar:
1. LDL-kolesterol: En sänkning med cirka 0,1-0,3 mmol/L.
2. Totalkolesterol: En sänkning med cirka 0,3-0,4 mmol/L.
3. Triglycerider: En sänkning med cirka 0,1-0,2 mmol/L.
4. HDL-kolesterol: Vanligtvis ingen signifikant effekt, men en liten ökning på upp till 0,1 mmol/L kan ses hos vissa patienter.
Dessa effekter bidrar till en förbättrad kardiovaskulär riskprofil för patienter som behandlas med metformin.
Rekommendationer för användning av metformin
Doseringsrekommendationer
Metformin administreras vanligtvis i en initial dos på 500 mg en till två gånger dagligen, som kan titreras upp beroende på patientens tolerans och glykemiska svar. Den maximala dosen är vanligtvis 2000-2550 mg per dag, beroende på preparat och patientens njurfunktion. Metformin bör tas med mat för att minimera gastrointestinala biverkningar, vilket är den vanligaste orsaken till avbrytande av behandlingen.
Biverkningar
De vanligaste biverkningarna av metformin inkluderar gastrointestinala problem, exempelvis:
- illamående
- kräkningar
- diarré
- magsmärtor
- gasbildning
Dessa biverkningar är ofta övergående och kan minskas genom att ta läkemedlet med mat och långsamt öka dosen.
Laktatacidos
En mer allvarlig men sällsynt biverkning är laktatacidos, vilket kan vara livshotande. Risken för laktatacidos är högre hos patienter med njurinsufficiens, leverinsufficiens eller andra tillstånd som påverkar syresättningen.
Symtom på laktatacidos inkluderar:
• Snabb och djup andning (hyperventilation)
• Svår muskeltrötthet eller muskelsmärta
• Buksmärtor
• Illamående eller kräkningar
• Förvirring eller minskad medvetandegrad
• Kall, klibbig hud
Vad patienter bör tänka på?
Patienter som tar metformin bör vara medvetna om vikten av regelbundna medicinska kontroller för att övervaka njurfunktionen och HbA1c-nivåerna. Det är också viktigt att rapportera eventuella tecken på laktatacidos, såsom muskelsmärta, andningsbesvär, trötthet eller oregelbundna hjärtslag, till sin läkare omedelbart. Patienter bör informeras om att undvika överdrivet alkoholintag, eftersom detta kan öka risken för laktatacidos.
Sulfonureider (SU-preparat)
Sulfonureider verkar genom att stimulera insulinfrisättningen från betacellerna i bukspottkörteln (paneras). Detta sker oberoende av blodsockernivåerna, vilket gör att de kan orsaka hypoglykemi (lågt blodsocker), särskilt när de inte kombineras med lämpliga kost- och motionsåtgärder.
Sulfonureider är därför särskilt effektiva i de tidiga stadierna av typ 2-diabetes, när betacellfunktionen fortfarande är relativt bevarad.
Hur fungerar sulfonureider?
Sulfonureider binder till specifika proteiner (receptorer) på ytan av beta-cellerna, kända som sulfonureareceptorer (SUR1). När sulfonureider binder till SUR1, leder detta till att kalcium tar sig in i beta-celler och stimulerar frisättning av hormonet insulin, vilket ökar insulinets tillgänglighet i blodet.
Insulin är nödvändigt för att cellerna ska ta upp blodsocker och när cellerna ökar sitt upptag av blodsocker så minskar mängden blodsocker.
Det finns flera sulfonureider som används kliniskt, var och en med olika styrkor och profiler. Här är några av de vanligaste generiska namnen är Glibenklamid och Glimepirid.
Kliniska effekter av sulfonureider
Effekt på dödlighet
Effekten av sulfonureider på mortalitet har varit föremål för omfattande forskning, men resultaten har varit blandade. Vissa studier har antytt att sulfonureider kan vara associerade med en ökad risk för kardiovaskulär dödlighet, särskilt när de jämförs med metformin.
Detta har lett till viss försiktighet i deras användning, särskilt hos patienter med hög kardiovaskulär risk. Dock har andra studier inte funnit någon signifikant ökning av mortaliteten, och sulfonureider används fortfarande brett, särskilt i kombination med andra antidiabetiska läkemedel.
1. All dödlighet: HR varierar, men i vissa studier är den omkring 1,10 (95% CI: 0,95–1,28), vilket antyder en potentiellt ökad risk.
2. Kardiovaskulär sjukdom: HR ligger ofta runt 1,10–1,20, vilket tyder på en något ökad risk för kardiovaskulära händelser.
3. Hjärtinfarkt: HR för hjärtinfarkt har rapporterats omkring 1,15 (95% CI: 1,02–1,30).
4. Stroke: HR varierar men ligger ofta runt 1,08–1,15, med en marginell ökning av risken.
5. Njurfunktion: Riskerna är blandade, men sulfonureider kan associeras med en förhöjd risk för försämrad njurfunktion, dock är specifika HR ofta inte väldefinierade.
Enligt europeiska riktlinjer används sulfonureider med försiktighet, särskilt hos patienter med hög kardiovaskulär risk, på grund av deras potentiellt negativa effekter på kardiovaskulär mortalitet.
Effekt på hjärt-kärlsjukdom
Effekten av sulfonureider på kardiovaskulär sjukdom är ett komplext och omdiskuterat ämne. Tidiga studier, såsom UGDP-studien (University Group Diabetes Program), föreslog en möjlig ökad risk för kardiovaskulära händelser med sulfonureider, särskilt tolbutamid. Senare studier har emellertid gett blandade resultat, och vissa moderna sulfonureider som glimepirid verkar ha en mer neutral effekt på kardiovaskulär risk.

Tänkbara orsaker till att SU-preparat kan öka risken för komplikation
- Ökad insulinfrisättning och hypoglykemi: Sulfonureider stimulerar kontinuerligt insulinfrisättning, vilket kan leda till hypoglykemi. Allvarlig hypoglykemi är kopplad till ökad kardiovaskulär dödlighet på grund av arytmier och andra hjärtrelaterade komplikationer.
- Effekt på jonkanaler i hjärtmuskeln: Sulfonureider blockerar K-ATP-kanaler i hjärtat, vilket kan minska hjärtats förmåga att hantera syrebrist (ischemisk stress). Detta kan potentiellt öka risken för hjärtinfarkt och andra kardiovaskulära händelser.
- Oxidativ stress och inflammation: Det har föreslagits att sulfonureider kan öka oxidativ stress och inflammation, vilket bidrar till ateroskleros och därmed ökar risken för kardiovaskulär sjukdom.
- Negativ påverkan på vaskulär funktion: Genom att påverka blodkärlsväggens inre celler (endotelcellernas) funktion kan sulfonureider minska blodkärlens förmåga att dilatera, vilket ökar risken för hypertoni och andra kardiovaskulära problem.
Dessa teorier grundar sig på observationer från kliniska studier samt experimentella data, men de exakta mekanismerna är fortfarande föremål för fortsatt forskning.
Effekt på njurfunktion
Njurfunktionen kan påverkas av sulfonureider, särskilt eftersom dessa läkemedel utsöndras via njurarna. Vid nedsatt njurfunktion ökar risken för hypoglykemi, eftersom läkemedlets halveringstid kan förlängas.
Vissa sulfonureider, såsom glipizid, anses vara säkrare vid nedsatt njurfunktion eftersom de har en kortare verkan och mindre ackumulering. Det är dock viktigt att justera dosen och monitorera njurfunktionen regelbundet hos patienter som tar sulfonureider.
Effekt på HbA1c
Sulfonureider (SU-preparat) har en signifikant effekt på HbA1c hos patienter med typ 2-diabetes. Generellt sett sänker dessa läkemedel HbA1c med cirka 11-22 mmol/mol från baslinjen.
Effekten är ofta mest uttalad hos patienter med högre initiala HbA1c-nivåer och de som nyligen har diagnostiserats med diabetes. Effekten tenderar att avta över tid, vilket kan bero på en gradvis förlust av betacellfunktion.
Effekt på blodtryck
Effekten av sulfonureider på blodtryck är i allmänhet neutral, men i vissa fall kan en förbättrad glykemisk kontroll leda till en måttlig sänkning av blodtrycket. Det är dock viktigt att notera att sulfonureider inte används specifikt för att behandla högt blodtryck, och deras påverkan på blodtryck är ofta marginell.
Effekt på blodfetter
Sulfonureider har en neutral till måttlig effekt på blodfetter. De påverkar vanligtvis inte blodfetter signifikant, men förbättrad glykemisk kontroll kan indirekt bidra till små förbättringar i blodfetter hos vissa patienter. Sulfonureider kombineras ofta med andra läkemedel som har starkare effekter på blodfetter, såsom statiner.
Rekommendationer för användning av sulfonureider
Doseringsrekommendationer
Dosen av sulfonureider bör anpassas individuellt baserat på patientens blodsockerkontroll och risk för hypoglykemi. Typiska startdoser är låga för att minska risken för hypoglykemi, med gradvis upptrappning tills glykemisk kontroll uppnås.
För glibenklamid är en vanlig startdos 2,5 mg en gång dagligen, medan för glipizid kan det vara 5 mg. Doserna kan ökas beroende på patientens svar, men maximala doser bör inte överskridas för att undvika allvarlig hypoglykemi.
Biverkningar
Den vanligaste och mest allvarliga biverkningen av sulfonureider är hypoglykemi, vilket kan vara särskilt farligt hos äldre patienter eller de med nedsatt njurfunktion. Andra biverkningar inkluderar viktökning, illamående, och i sällsynta fall, allergiska reaktioner.
Långvarig användning av sulfonureider har också associerats med en ökad risk för kardiovaskulära händelser, även om detta är omtvistat och kan variera beroende på det specifika läkemedlet.
Vad patienter bör tänka på?
Patienter som tar sulfonureider bör vara medvetna om risken för hypoglykemi och utbildas i att känna igen dess symtom, såsom skakningar, svettningar, förvirring, och hjärtklappning. Det är viktigt att ta läkemedlet i samband med måltider för att minimera risken för hypoglykemi.
Patienter bör också regelbundet övervaka sitt blodsocker och ha en plan för att hantera lågt blodsocker, såsom att alltid ha en snabbverkande kolhydratkälla till hands.
Dessutom bör patienter informera sin läkare om alla andra mediciner eller kosttillskott de tar, eftersom vissa kan interagera med sulfonureider och påverka deras effektivitet eller säkerhet.
DPP-4 hämmare
Dipeptidylpeptidas-4-hämmare (DPP-4-hämmare) är en relativt ny klass av orala diabetesläkemedel som har blivit en viktig komponent i behandlingen av typ 2 diabetes. Dessa läkemedel fungerar genom att öka insulinnivåerna och minska glukagonproduktionen, vilket leder till bättre blodsockerkontroll. Glukagon är ett hormon som frisätta i kroppen och leder till en ökad frisättning socker från levern.
DPP-4-hämmarnas funktion i kroppen
DPP-4-hämmare fungerar genom att blockera enzymet dipeptidylpeptidas-4 (DPP-4), som är ansvarigt för nedbrytningen av inkretinhormonerna glukagonlik peptid-1 (GLP-1) och glukosberoende insulinotropiskt polypeptid (GIP).
Dessa hormoner frisätts från tarmen efter måltid och spelar en viktig roll i regleringen av glukoshomeostasen genom att stimulera insulinsekretion och hämma glukagonfrisättning.
Genom att hämma DPP-4 förlänger DPP-4-hämmarna halveringstiden för dessa inkretinhormoner, vilket resulterar i ökad insulinproduktion och minskad glukosproduktion i levern.
Hur funkar det på cellnivå?
DPP-4 är ett enzym som klyver och inaktiverar inkretiner, särskilt GLP-1 och GIP. När DPP-4 hämmas, förlängs verkan av dessa inkretinhormoner, vilket leder till ökad glukosberoende insulinfrisättning från betaceller och minskad glukagonfrisättning från alfaceller.
GLP-1 och GIP har också effekter på magsäckstömningen och aptitreglering, även om dessa effekter är mer uttalade med GLP-1-receptoragonister än med DPP-4-hämmare.
Det är dock viktigt att notera att DPP-4-hämmare inte direkt stimulerar insulinfrisättning vid låga glukosnivåer, vilket minskar risken för hypoglykemi jämfört med andra antidiabetika.
Olika DPP-4-hämmare
Det finns flera DPP-4-hämmare som har godkänts för klinisk användning, och några av de mest kända inkluderar:
• Sitagliptin (Januvia)
• Saxagliptin (Onglyza)
• Linagliptin (Tradjenta)
• Alogliptin (Nesina)
• Vildagliptin (Galvus)
Kliniska effekter av DPP-4-hämmare
Hur påverkar det dödlighet?
Effekten av DPP-4-hämmare på total mortalitet har studerats i flera stora kliniska prövningar, inklusive TECOS (för sitagliptin) och SAVOR-TIMI 53 (för saxagliptin). Dessa studier har generellt sett visat att DPP-4-hämmare inte ökar risken för kardiovaskulär dödlighet, och de har en neutral effekt på total mortalitet.
Detta gör DPP-4-hämmare till ett säkert alternativ för patienter med typ 2-diabetes, särskilt de med hög risk för kardiovaskulära händelser.
Effekt på hjärt-kärlsjukdomar
Kardiovaskulära utfall har varit ett stort fokus i studier av DPP-4-hämmare. TECOS-studien visade att sitagliptin hade en neutral effekt på risken för stora kardiovaskulära händelser (MACE), medan SAVOR-TIMI 53-studien indikerade en ökad risk för hjärtsviktssjukdom med saxagliptin.

Dessa resultat har lett till att vissa DPP-4-hämmare används med försiktighet hos patienter med tidigare hjärtsvikt. Överlag verkar DPP-4-hämmare inte ha någon stark kardiovaskulär skyddseffekt, men de ökar inte heller risken för kardiovaskulära händelser förutom i specifika subgrupper.
Effekt på njurfunktion
DPP-4-hämmare har visat sig vara säkra och effektiva även hos patienter med nedsatt njurfunktion. Linagliptin, till exempel, utsöndras huvudsakligen via gallan, vilket gör det till ett bra alternativ för patienter med nedsatt njurfunktion.
Andra DPP-4-hämmare, som sitagliptin och saxagliptin, kräver dosjustering baserat på graden av njurinsufficiens. Generellt sett har DPP-4-hämmare en neutral till något fördelaktig effekt på njurfunktion, vilket gör dem till en lämplig behandling för patienter med både diabetes och kronisk njursjukdom.
Effekt på HbA1c
DPP-4-hämmare är effektiva för att sänka HbA1c, med en genomsnittlig sänkning på cirka 0,5-1%. Detta gör dem till ett måttligt potent alternativ för glykemisk kontroll, ofta använd som tillägg till metformin eller andra antidiabetiska läkemedel när monoterapi inte är tillräcklig. Deras effekt på HbA1c är stabil över tid, vilket gör dem till ett långsiktigt behandlingsalternativ för många patienter.

Effekt på blodtryck
Effekten av DPP-4-hämmare på blodtryck är i allmänhet neutral. Det finns inga starka bevis för att dessa läkemedel signifikant sänker blodtrycket, även om viss förbättring i systoliskt blodtryck har rapporterats i vissa studier. Deras neutrala effekt på blodtryck gör dem till ett säkert alternativ för patienter med normotension eller lätt förhöjt blodtryck.
Effekt på lipidnivåer
DPP-4-hämmare har en neutral effekt på lipidnivåer, med inga signifikanta förändringar i LDL-kolesterol, HDL-kolesterol eller triglycerider. Detta gör dem lämpliga för patienter som redan är på statinbehandling eller som har stabila lipidnivåer och där behovet av lipidmodifiering inte är det primära målet.
Rekommendationer för användning av DPP-4-hämmare
Doseringsrekommendationer
DPP-4-hämmare tas vanligtvis en gång dagligen, med eller utan mat, vilket gör dem enkla att integrera i patientens dagliga rutiner. Doseringen beror på den specifika DPP-4-hämmaren och patientens njurfunktion.
För sitagliptin är standarddosen 100 mg dagligen, men den kan justeras vid nedsatt njurfunktion. Linagliptin, som inte kräver dosjustering för njurfunktion, ges vanligtvis i en dos av 5 mg dagligen.
Biverkningar
DPP-4-hämmare tolereras generellt sett väl, med få biverkningar. Den vanligaste biverkningen är nasofaryngit (förkylning), men allvarliga biverkningar är sällsynta. Risken för hypoglykemi är låg när DPP-4-hämmare används som monoterapi eller i kombination med metformin, men risken ökar när de kombineras med sulfonureider eller insulin. Några rapporter har också pekat på en möjlig ökad risk för pankreatit, även om detta inte har bekräftats i större studier.
Vad patienter bör tänka på?
Patienter som tar DPP-4-hämmare bör informeras om den låga risken för hypoglykemi, särskilt om de tar andra läkemedel som kan orsaka lågt blodsocker. Det är också viktigt att rapportera eventuella ovanliga buksmärtor eller tecken på pankreatit, såsom svår smärta i övre delen av magen som strålar ut till ryggen. Regelbundna kontroller av HbA1c och njurfunktion rekommenderas för att säkerställa att behandlingen är effektiv och säker.
GLP-1 analoger (Wegovy och ozempic)
GLP-1-receptoragonister (Glukagonliknande peptid-1 receptoragonister) är en klass av läkemedel som har revolutionerat behandlingen av typ 2-diabetes. Dessa läkemedel efterliknar effekterna av det endogena hormonet GLP-1 och erbjuder inte bara glykemisk kontroll utan också viktminskning och skydd mot kardiovaskulära händelser.
GLP-1-receptoragonisters funktion i kroppen
GLP-1 är ett inkretinhormon som utsöndras av L-celler i tarmen som svar på födointag. Hormonet spelar en avgörande roll i regleringen av glukoshomeostasen genom att stimulera insulinsekretion från betaceller i pankreas, hämma glukagonsekretion från alfaceller, fördröja magsäckstömning och minska aptiten.

Positiva egenskaper med GLP-1 behandling
- Förbättrar minnet
- Reparation av hjärnskador
- Minskar demensutveckling
- Minskar risken för hjärtsvikt (både hjärtsvikt med nedsatt- och bevarad pumpförmåga)
- Minskar risken för hjärtinfarkt, stroke och andra kärlsjukdomar
- Ökar glykogeninlagring i levern
- Ökar upptaget av socker i fettceller
- Ökar förbränningen av fett
- Ökar utsöndringen av salt (natrium) via njurar
- Förbättrar kärlfunktionen
- Ökat upptag av socker i muskeln
- Ökar nybildningen av insulinproducerande beta-celler i bukspottkörteln
- Bromsar celldöd för beta-celler i bukspottkörteln
- Minskar syrebrist i hjärtmuskeln
- Ökar förbränningen av fett i buken, lever, runt hjärtat
- Ökar förbränningen av fett i levern
- Minskar risken för vissa cancersjukdomar
GLP-1-receptoragonister är läkemedel som efterliknar dessa effekter och är designade för att vara mer resistenta mot enzymatisk nedbrytning än det naturliga hormonet, vilket ger en längre verkan.
Hur fungerar GLP-1 analoger?
GLP-1-receptoragonister binder till GLP-1-receptorer på betaceller i pankreas. Detta leder till aktivering av adenylatcyklas, vilket ökar cAMP-nivåerna och aktiverar proteinkinas A (PKA). PKA i sin tur aktiverar proteiner som underlättar utsöndringen (exocytos) av vesiklar (säckar) med insulin.
Samtidigt hämmas glukagonsekretion genom mekanismer som ännu inte är helt klarlagda men som också involverar GLP-1-receptorn. Glukagon är ett viktigt hormon för att öka frisättningen av socker från levern. Fördröjningen av magsäckstömningen och aptitminskningen tros medieras genom centrala nervsystemet, där GLP-1-receptorer finns i hypothalamus och andra hjärnområden.
Generiska namn för GLP-1-receptoragonister
Det finns flera GLP-1-receptoragonister som är godkända för behandling av typ 2-diabetes, inklusive:
• Exenatid (Byetta, Bydureon)
• Liraglutid (Victoza, Saxenda)
• Dulaglutid (Trulicity)
• Semaglutid (Ozempic, Rybelsus)
• Lixisenatid (Adlyxin)
Varje läkemedel har sina egna farmakokinetiska profiler och administreringssätt, från dagliga injektioner till veckovisa injektioner och till och med orala formuleringar (semaglutid).
Kliniska effekter av GLP-1-receptoragonister
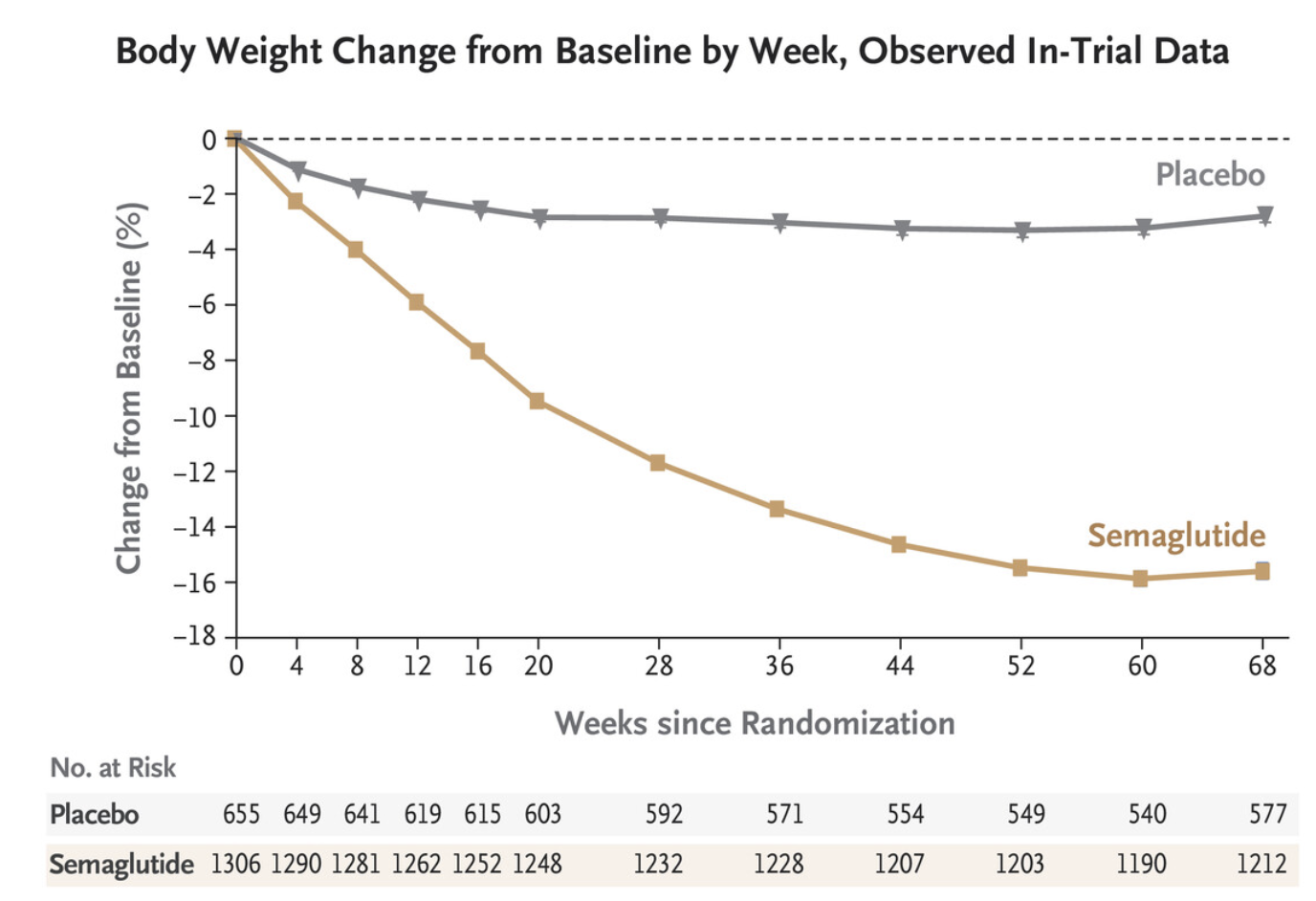
Viktnedgång



Effekt på mortalitet
Flera kliniska prövningar har visat att GLP-1-receptoragonister minskar risken för kardiovaskulär dödlighet hos patienter med typ 2-diabetes. LEADER-studien visade till exempel att liraglutid signifikant minskade risken för kardiovaskulära händelser och död. Liknande resultat har setts med semaglutid i SUSTAIN-studierna, där även en minskad total dödlighet observerades på cirka 20%.
Effekt på kardiovaskulär sjukdom
GLP-1-receptoragonister har konsekvent visat fördelar i stora kardiovaskulära utfallsstudier. Dessa läkemedel minskar risken för stora kardiovaskulära händelser, inklusive hjärtinfarkt och stroke. Detta gör dem till en attraktiv behandlingsoption för patienter med typ 2-diabetes som också har hög kardiovaskulär risk.
Njurfunktion
GLP-1-receptoragonister har också visat fördelar för njurfunktionen, inklusive minskad risk för progression av nefropati och minskad albuminuri. Detta är särskilt viktigt för patienter med diabetes, som ofta är i riskzonen för att utveckla kronisk njursjukdom. Liraglutid och semaglutid har i sina respektive studier visat sig ha njurskyddande effekter.
HbA1c
GLP-1-receptoragonister är mycket effektiva för att sänka HbA1c, med genomsnittliga sänkningar på 10-20 mmol/mol. Detta gör dem till en kraftfull behandling för glykemisk kontroll, särskilt hos patienter som har svårt att uppnå målnivåer med andra läkemedel. Deras effekt på HbA1c är ofta långvarig och bibehålls över tid.
Blodtryck
GLP-1-receptoragonister har visat sig ha en måttlig sänkningseffekt på blodtryck, särskilt systoliskt blodtryck. Detta kan delvis bero på deras effekt på viktminskning och förbättrad insulinkänslighet. Blodtryckssänkningen är en ytterligare fördel för patienter med typ 2-diabetes, som ofta också lider av hypertoni.
Effekt på blodfetter
GLP-1-receptoragonister har en positiv effekt på lipidprofilen, inklusive sänkning av LDL-kolesterol och triglycerider samt en ökning av HDL-kolesterol. Dessa förändringar bidrar till deras kardiovaskulära fördelar och gör dem till ett bra alternativ för patienter med dyslipidemi.
GLP-1 är en behandling som i princip kan ersätta olika blodfettssänkande mediciner och blodtryckspreparat med tanke på att den är lika effektiv som statiner och blodtryckssänkande mediciner.
Rekommendationer för användning av GLP-1-receptoragonister
Doseringsrekommendationer
Doseringsregimerna för GLP-1-receptoragonister varierar beroende på läkemedel och formulering. Exenatid administreras till exempel två gånger dagligen (Byetta) eller en gång i veckan (Bydureon), medan liraglutid ges som en daglig injektion och semaglutid kan ges som veckoinjektion eller daglig tablett.
Doserna justeras baserat på patientens glykemiska svar och tolerans. Det är viktigt att börja med en låg dos och gradvis öka för att minimera gastrointestinala biverkningar.
Biverkningar
Den vanligaste biverkningen av GLP-1-receptoragonister är gastrointestinala besvär, såsom illamående, kräkningar och diarré, särskilt i början av behandlingen. Dessa biverkningar tenderar att minska över tid och kan ofta hanteras genom långsam dosupptrappning.
Illamående
- Frekvens: Mycket vanligt (>10%)
- Råd: Starta med en låg dos och öka långsamt. Ta medicinen med mat för att minska risken för illamående.
Kräkningar
- Frekvens: Vanligt (1-10%)
- Råd: Liksom för illamående, öka dosen långsamt och undvik stora måltider. Drick små mängder vätska ofta.
Diarré
- Frekvens: Vanligt (1-10%)
- Råd: Undvik feta och kryddiga livsmedel. Öka vätskeintaget för att undvika uttorkning.
Förstoppning
- Frekvens: Vanligt (1-10%)
- Råd: Öka fiberintaget och drick mycket vatten. Motion kan också hjälpa till att främja tarmrörelser.
Buksmärtor
- Frekvens: Vanligt (1-10%)
- Råd: Undvik stora måltider och ät långsamt. Om smärtan är svår, kontakta läkare.
Dyspepsi (matsmältningsbesvär)
- Frekvens: Vanligt (1-10%)
- Råd: Undvik fet och starkt kryddad mat. Att äta små, frekventa måltider kan hjälpa.
Minskad aptit
- Frekvens: Vanligt (1-10%)
- Råd: Detta kan vara en önskad effekt för viktminskning. Men se till att du ändå får i dig tillräckligt med näringsämnen.
Huvudvärk
- Frekvens: Mycket vanligt (>10%)
- Råd: Drick tillräckligt med vätska och undvik att hoppa över måltider. Vila och använd smärtlindring vid behov.
Yrsel
- Frekvens: Mindre vanligt (0,1-1%)
- Råd: Res dig långsamt från sittande eller liggande position. Undvik plötsliga rörelser. Kontrollera blodtrycket om du använder blodtryckssänkande mediciner eftersom GLP-1 har en påtaglig effekt på blodtrycket som vårdpersonal oftast bortser från.
Trötthet
- Frekvens: Mindre vanligt (0,1-1%)
- Råd: Se till att få tillräckligt med sömn och vila. Om tröttheten är uttalad eller långvarig, kontakta läkare. Trötthet kan ibland bero på kraftig viktnedgång i kombination med lågt blodsocker eftersom födointaget minskar i samband med GLP-1 analoger. Kontroller blodsockret om möjligt.
Hudutslag
- Frekvens: Sällsynt (0,01-0,1%)
- Råd: Om utslag uppstår, kontakta läkare. Använd milda hudprodukter och undvik starka tvålar eller kemikalier.
Hypoglykemi (lågt blodsocker) – oftast i kombination med andra diabetesläkemedel
- Frekvens: Vanligt (1-10%)
- Råd: Övervaka blodsockernivåer regelbundet. Ha alltid med dig en snabb kolhydratkälla, såsom druvsocker eller juice. Lågt blodsocker vid GLP-1 användning uppstår inte snabbt såsom vid insulinbehandling och därav kan du behöva minska dosen GLP-1 för att minska trötthet och gränslågt blodsocker.
Pankreatit (inflammation i bukspottkörteln)
- Frekvens: Mycket sällsynt (<0,01%)
- Råd: Om du upplever svåra buksmärtor, sluta ta medicinen och kontakta läkare omedelbart. Symtom vid pankreatit inkluderar buksmärtor, feber, snabb hjärtfrekvens, svullen buk, gulsot, svettningar, trötthet och svaghet.
Gallstenssjukdom
- Frekvens: Sällsynt (0,01-0,1%)
- Råd: Undvik fet mat och bibehåll en hälsosam vikt. Om du upplever symtom på gallstenssjukdom, som kraftig buksmärta, kontakta läkare. Gallstenar ger oftast symtom i samband med födointag, särskilt mat som är rik på fett.
Leverskada (förhöjda leverenzymer)
- Frekvens: Mindre vanligt (0,1-1%)
- Råd: Regelbundna blodprover för att övervaka leverfunktionen. Undvik alkohol och levertoxiska läkemedel.
Njurpåverkan
- Frekvens: Sällsynt (0,01-0,1%)
- Råd: Övervaka njurfunktionen regelbundet. Drick tillräckligt med vatten och undvik uttorkning. Njurpåverkan anges som en biverkan på www.Fass.se
Sköldkörtelproblem (inklusive sköldkörtelcancer)
- Frekvens: Mycket sällsynt (<0,01%)
- Råd: Rapportera eventuella symtom som knölar i halsen, svårigheter att svälja eller andas. Regelbunden medicinsk övervakning.
Allergiska reaktioner
- Frekvens: Sällsynt (0,01-0,1%)
- Råd: Om du upplever svårigheter att andas, svullnad eller nässelfeber, sök omedelbar medicinsk hjälp.
Håravfall
- Håravfall rapporterades hos 2,5 % av patienterna som fick behandling med semaglutid och hos 1,0 % av de som fick placebo. Dessa biverkningar var i huvudsak av mild karaktär och de flesta patienterna återhämtade sig medan de fortsatte behandlingen. Håravfall förekom oftare hos patienter som upplevde en större viktminskning (≥20 %).
Vad patienter bör tänka på?
Patienter som tar GLP-1-receptoragonister bör vara medvetna om risken för gastrointestinala biverkningar och informeras om att dessa vanligtvis minskar med tiden. Det är också viktigt att rapportera tecken på pankreatit, såsom svår buksmärta, till läkare omedelbart.
Patienter bör också följa sin läkare eller diabetesvårdgivares rekommendationer om dosering och injektionsteknik för att optimera behandlingen och minska risken för biverkningar.
GLP-1-analoger som Semaglutid (Rybelsus, Ozempic, Wegovy), Tirzepatid och Retatutrid har genom kliniska prövningar visat sig ha signifikanta effekter på olika hälsoutfall, inklusive dödlighet, hjärt-kärlsjukdomar (som hjärtsvikt, HFpEF och HFrEF), blodsockerkontroll (mätt genom HbA1c), blodtryck, blodfetter och njurfunktion.
Överlevnad och hjärt-kärlsjukdomar
Studier har visat att GLP-1-analoger kan minska risken för kardiovaskulära händelser och dödlighet hos personer med typ 2-diabetes och hög kardiovaskulär risk. Särskilt Semaglutid har visat sig minska risken för större kardiovaskulära händelser (som hjärtinfarkt och stroke).
Effekten på hjärtsvikt är också lovande, med förbättringar i både HFpEF (hjärtsvikt med bevarad ejektionsfraktion) och HFrEF (hjärtsvikt med reducerad ejektionsfraktion).
HbA1c och blodsockerkontroll:
GLP-1-analoger har en kraftfull effekt på blodsockerkontroll, vilket återspeglas i signifikanta minskningar av HbA1c. Dessa minskningar kan vara på flera mmol/mol, vilket indikerar en förbättrad långsiktig blodsockerkontroll. Semaglutid och Tirzepatid har visat sig särskilt effektiva i detta avseende.
Blodtryck:
GLP-1-analoger har också visat sig ha en modest men kliniskt relevant blodtryckssänkande effekt. Minskningar i systoliskt blodtryck kan variera, men är vanligtvis i intervallet 2-5 mmHg, vilket bidrar till en minskad kardiovaskulär risk.
Lipider:
Effekten på blodfetter (lipider) inkluderar ofta en sänkning av triglycerider och i vissa fall en liten ökning av HDL-kolesterol (“det goda kolesterolet”). Dessa förändringar kan ytterligare minska risken för kardiovaskulära händelser.
Njurfunktion:
GLP-1-analoger har också visat fördelar för njurfunktionen, med skyddande effekter som kan bidra till att fördröja försämringen av njurfunktionen hos patienter med typ 2-diabetes. Denna effekt är särskilt viktig eftersom njursjukdom är en vanlig komplikation vid diabetes.
Sammanfattningsvis visar kliniska prövningar att GLP-1-analoger har omfattande hälsofördelar utöver blodsockerkontroll, inklusive förbättringar i hjärt-kärlhälsa, blodtryck, lipider och njurfunktion, vilket kan leda till minskad dödlighet och förbättrad livskvalitet hos patienter med typ 2 diabetes.
SGLT-2 hämmare
SGLT2-hämmare (Sodium-Glucose Co-Transporter 2 inhibitors) är en relativt ny klass av läkemedel som används för att behandla typ 2-diabetes. De har snabbt blivit en viktig del av behandlingsstrategierna tack vare deras unika verkningsmekanism och positiva effekter på både glykemisk kontroll och hjärt-kärlhälsa.
I denna artikel utforskar vi hur SGLT2-hämmare fungerar i kroppen, deras molekylära verkningsvägar, kliniska effekter, samt råd för användning och vad patienter bör vara medvetna om.
SGLT2-hämmarnas funktion i kroppen
SGLT2-hämmare verkar genom att blockera SGLT2-proteinet i njurarna, vilket normalt återabsorberar glukos från primärurinen tillbaka till blodomloppet. Genom att hämma detta transportprotein förhindrar SGLT2-hämmare återupptaget av glukos, vilket leder till att överskottet av glukos utsöndras i urinen.
Detta minskar blodglukosnivåerna och bidrar till en förbättrad glykemisk kontroll hos patienter med typ 2-diabetes.
Molekylär mekanism
SGLT2 (Sodium-Glucose Co-Transporter 2) är ett protein som uttrycks i njurens proximala tubuli och ansvarar för återabsorption av cirka 90% av det filtrerade glukoset i njurarna.
Genom att blockera SGLT2 förhindrar hämmarna denna återabsorption, vilket leder till en ökad glukosutsöndring via urinen (glukosuri). Detta minskar inte bara blodsockernivåerna utan medför även en viss kaloriförlust, vilket kan bidra till viktminskning hos patienter.
Generiska namn för SGLT2-hämmare
De mest kända SGLT2-hämmarna som har godkänts för klinisk användning inkluderar:
• Dapagliflozin (Forxiga)
• Empagliflozin (Jardiance)
• Canagliflozin (Invokana)
• Ertugliflozin (Steglatro)
Dessa läkemedel har något olika farmakokinetiska egenskaper men fungerar alla genom samma grundläggande verkningsmekanism.
Kliniska effekter av SGLT2-hämmare
Effekt på mortalitet
Stora kliniska prövningar, som EMPA-REG OUTCOME (empagliflozin) och CANVAS (canagliflozin), har visat att SGLT2-hämmare signifikant minskar risken för kardiovaskulär dödlighet hos patienter med typ 2-diabetes och hög kardiovaskulär risk.
Detta har gjort SGLT2-hämmare särskilt attraktiva för patienter med en historia av hjärt-kärlsjukdom, eftersom de inte bara förbättrar blodsockerkontrollen utan även förlänger överlevnaden.
Effekt på kardiovaskulär sjukdom
Förutom att minska kardiovaskulär dödlighet har SGLT2-hämmare också visat sig minska risken för hjärtsvikt och relaterade sjukhusinläggningar. EMPA-REG OUTCOME visade att empagliflozin minskade risken för sjukhusinläggning på grund av hjärtsvikt med 35%.
Liknande resultat har observerats med dapagliflozin i DAPA-HF-studien, där läkemedlet minskade risken för förvärrad hjärtsvikt och kardiovaskulär död även hos patienter utan diabetes.
Effekt på njurfunktion
Njurskydd är en annan stor fördel med SGLT2-hämmare. Dessa läkemedel har visat sig minska progressionen av njursjukdom, särskilt i patienter med typ 2-diabetes och nedsatt njurfunktion.
Studier som CREDENCE (canagliflozin) har visat att SGLT2-hämmare signifikant minskar risken för njurrelaterade utfall, inklusive behov av dialys eller njurtransplantation. Detta njurskydd beror troligen på en kombination av sänkt intraglomerulärt tryck, minskad hyperfiltration och förbättrad glukoskontroll.
Effekt på HbA1c
SGLT2-hämmare har visat sig sänka HbA1c-nivåerna med cirka 0,5-1%. Även om denna sänkning kan vara måttlig jämfört med andra antidiabetika, är det viktigt att notera att effekten ofta är långvarig och associerad med ytterligare fördelar som viktminskning och blodtryckssänkning.
Dessa egenskaper gör SGLT2-hämmare till ett bra alternativ för många patienter, särskilt när viktminskning är ett sekundärt behandlingsmål.
Effekt på blodtryck
SGLT2-hämmare har en tydlig blodtryckssänkande effekt, vilket delvis kan förklaras av den ökade diuresen och natriuresen (utsöndring av natrium) som uppstår när glukos dras ut ur kroppen via urinen.
Sänkningen av systoliskt blodtryck är i genomsnitt cirka 3-5 mmHg, vilket kan vara en betydande fördel för patienter med samtidig hypertoni.
Effekt på lipidnivåer
Effekten av SGLT2-hämmare på lipidprofilen är generellt neutral till lätt förhöjning av LDL-kolesterol och HDL-kolesterol. Triglyceridnivåerna påverkas vanligtvis inte signifikant.
Trots denna ökning av LDL-kolesterol är den övergripande kardiovaskulära risken minskad, vilket tyder på att de fördelaktiga effekterna på hjärt-kärlsystemet överväger denna lipidförändring.
Rekommendationer för användning av SGLT2-hämmare
Doseringsrekommendationer
SGLT2-hämmare tas vanligtvis en gång dagligen, med eller utan mat. Doseringen kan variera beroende på specifikt läkemedel och patientens njurfunktion. För exempelvis dapagliflozin rekommenderas en startdos på 10 mg dagligen, medan empagliflozin ofta ges i doser av 10 mg eller 25 mg dagligen. Justering av dosen kan vara nödvändig baserat på njurfunktion och andra individuella faktorer.
Biverkningar
Den vanligaste biverkningen av SGLT2-hämmare är ökade urinvägsinfektioner och genitala infektioner, vilket beror på den ökade glukosutsöndringen i urinen som kan skapa en gynnsam miljö för bakterier och jästsvampar. Dessa infektioner är vanligtvis milda och hanterbara med rätt behandling.
Andra biverkningar inkluderar hypovolemi, särskilt hos äldre patienter eller de som tar diuretika. Det finns också en något ökad risk för ketoacidos, även om detta är sällsynt.
Vad patienter bör tänka på?
Patienter som tar SGLT2-hämmare bör vara medvetna om risken för urinvägs- och genitala infektioner och uppmuntras till god personlig hygien för att minska denna risk. Det är också viktigt att dricka tillräckligt med vätska för att förhindra uttorkning, särskilt under varma väderförhållanden eller vid fysisk aktivitet.
Patienter bör också vara medvetna om symtom på ketoacidos, såsom illamående, kräkningar, buksmärtor och andningssvårigheter, och söka omedelbar medicinsk hjälp om dessa uppstår.